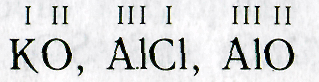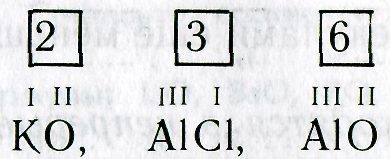Для того чтобы научиться составлять химические формулы необходимо выяснить закономерности, согласно которым атомы химических элементов соединяются между собой в определенных соотношениях. Для этого сравним качествен-ный и количественный состав соединений, формулы кото-рых HCl, H 2 O, NH 3 , CH 4 (рис. 12.1)
По качественному составу эти вещества схожи:в состав каждой из молекул входят атомы водорода. Тем не менее их количественный состав неодинаков. Атомы хлора, кислорода, азота, углерода соединены соответственно с одним, двумя, тремя и четырьмя атомами водорода
Эту закономерность подметил еще в начале XI в. Дж. Дальтон. Со временем И. Я. Берцелиус обнаружил, что наиболь-шее количество атомов, соединенных с атомом химического элемента, не превышает определенной величины. В 1858 г. Э. Франкленд назвал «соединительной силой» способность атомов связывать или замещать определенное число других атомов Термин «валентность»
(от лат. valentia —
«сила») предложил в 1868 г. немецкий химик К. Г. Вихельхауз.
Валентность
— общее свойство атомов. Она характе-ризует способность атомов химически (валентными си-лами) взаимодействовать друг с другом.
Валентность многих химических элементов определили на основе экспериментальных данных о количественном и качественном составе веществ. За единицу валентности
бы-ла принята валентностьатома водорода. Если атом хими-ческого элемента соединен с двумя одновалентными атома-ми, то его валентность равна двум. Если он соединен с тремя одновалентными атомами, то он — трехвалентен и т. д.
Наи-высшее значение валентности химических элементов — VIII
.
Валентность обозначают римскими цифрами. Обозначим валентность в формулах рассмотренных соединений:
Также ученые обнаружили, что немало элементов в раз-ных соединениях проявляют разные значения валентности. То есть существуют химические элементы с постоянной и переменной валентностью.
Можно ли определить валентность по положению хими-ческого элемента в периодической системе?
Максимальное значение валентности элемента совпадает с номером группы периодической системы, в которой он размещен. Тем не менее бывают и исключения — азот, кислород, фтор, медь и некото-рые другие элементы. Запомни
: номер группы обозначен римской цифрой над соответствующим вертикальным столби-ком периодической системы.
Таблица. Химические элементы с постоянной валентностью
|
Элемент
|
Валентность
|
Элемент
|
Валентность
|
|
Водород (Н)
|
|
Кальций (Са)
|
|
|
Натрий (Na)
|
|
Барий (Ва)
|
|
|
|
|
|
|
|
|
|
Кислород(O)
|
|
|
Бериллий(Be)
|
|
Алюминий (Al)
|
|
|
Магний (Mg)
|
|
|
|
Таблица. Химические элементы с переменной валентностью
|
Элемент
|
Валентность
|
Элемент
|
Валентность
|
|
|
|
Железо (Fe)
|
|
|
|
|
|
|
|
|
|
Марганец (Mg)
|
|
|
|
|
|
II, III, VI Материал с сайта
|
|
|
|
|
|
|
Серебро (Ag)
|
|
Фосфор (P)
|
|
|
Золото (Au)
|
|
Мышьяк (As)
|
|
|
|
|
Углерод (C)
|
|
|
Свинец (Pb)
|
|
Кремний (Si)
|
|
На этой странице материал по темам:
1
§ 11. Валентность химических элементов
Понятие о валентности.
Химические формулы можно вывести на основании данных о составе веществ. Однако
чаще всего при составлении химических формул учитываются закономерности, которым подчиняются химические элементы , соединяясь между собой. Чтобы понять сущность этих закономерностей, следует ознакомиться со свойством атомов, которое называется валентностью.
Рассмотрим химические формулы соединений некоторых элементов с водородом: НС1 Н 2 О NH 3 СН 4 Хлороводород вода аммиак метан Как видно из приведенных примеров, атомы элементов хлора, кислорода, азота, углерода обладают свойством присоединять не любое, а только определенное число атомов водорода. Таким же свойством обладают и другие элементы в различных соединениях. Понятию «валентность» можно дать следующее определение: Валентность - это свойство атомов химического элемента присоединять определенное число атомов других химических элементов.
Атомы водорода не могут присоединять более одного атома другого химического элемента, поэтому валентность водорода принята за единицу. Валентность же других элементов можно выразить числом , показывающим, сколько атомов водорода может присоединить к себе атом данного элемента. Например, в молекуле хлороводорода атом хлора присоединяет один атом водорода, следовательно, хлор одновалентен. Валентность кислорода равна двум, ибо его один атом присоединяет два атома водорода. Азот в молекуле аммиака трехвалентен, а углерод четырехвалентен. Это можно записать следующим образом:
(Численное значение валентности принято обозначать римскими цифрами, которые ставятся над знаками химических элементов.)
Валентность элементов определяют также по кислороду, который обычно двухвалентен. Например, ртуть Hg и медь Сu образуют оксиды HgO и СuО. Так как кислород двухвалентен и в этих оксидах на один атом элемента приходится по одному атому кислорода , то ртуть и медь в этих соединениях двухвалентны.
Ответьте на вопросы 1-3 (с. 32).
§12. Определение валентности элементов по формулам их соединений. Составление химических формул по валентности
Определение валентности элементов по формулам их соединений.
Зная формулы веществ, состоящих из двух химических элементов, и валентность одного из них, можно определить валентность другого элемента. Например, если дана формула оксида меди СuО, то валентность меди можно определить следующим образом. Валентность кислорода равна двум, а на один атом кислорода приходится один атом меди. Следовательно, валентность меди тоже равна двум. Несколько сложнее определить валентность по формулам соединений, образованных не одним, а несколькими атомами химических элементов. Например, чтобы определить валентность железа в оксиде железа Fe 2 O 3 , рассуждают так. Валентность кислорода равна двум. Общее число единиц валентностей трех атомов кислорода равно шести (2-3). Следовательно, шесть валентностей приходятся на два атома железа , а на один атом железа приходятся три единицы валентности (6:2). При определении валентности элемента по формуле следует учитывать, что число единиц валентности всех атомов одного элемента должно быть равно числу единиц валентности всех атомов другого элемента.
Итак, валентность элементов по формулам можно определить следующим образом: 1
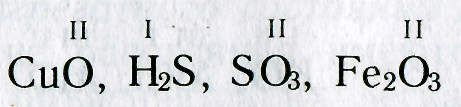 . Пишут химическую формулу вещества и отмечают валентность известного элемента. . Пишут химическую формулу вещества и отмечают валентность известного элемента. 2. Находят и записывают общее число валентностей (наименьшее общее кратное) известного элемента:
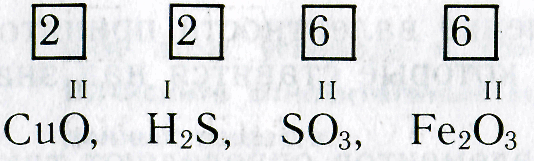
3
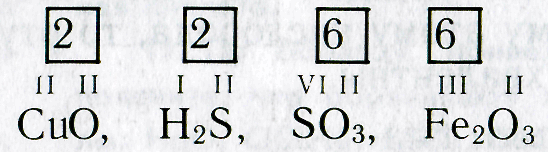 . Вычисляют и проставляют над химическими знаками валентность другого элемента. Для этого общее число валентностей делят на индекс этого элемента: . Вычисляют и проставляют над химическими знаками валентность другого элемента. Для этого общее число валентностей делят на индекс этого элемента:
Составление химических формул по валентности.
Чтобы составить химическую формулу, необходимо знать валентность элементов, образующих данное химическое соединение. Сведения о валентности некоторых элементов приведены в таблице 3.
Таблица 3. Валентность некоторых элементов в химических соединени
Валентность
|
Химические элементы
|
Примеры формул соединений
|
| | |
| |
С постоянной валентностью
| |
I
|
Н, Na, К, Li
|
Н 2 О, Na 2 O
|
II
|
О, Be, Mg, Ca, Ba, Zn
|
MgO, CaO
|
III
|
А1, В
|
А1 2 Оз
|
| |
С переменной валентностью
| |
|
|
Си
|
Cu 2 O, CuO
|
II и III
|
Fe, Co, Ni
|
FeO, Fe 2 O 3
|
II и IV
|
Sn, Pb
|
SnO, SnO 2
|
III и V
|
Р
|
PH 3 , P 2 O 5
|
II, III и VI
|
Cr
|
CrO, Сг 2 О 3 , СгОз
|
II, IV и VI
|
S
|
H 2 S, SO 2 , SO 3
|
При составлении химических формул можно соблюдать следующий порядок действий: 1. Пишут рядом химические знаки элементов, которые входят в состав соединения: КО, А1С1, А1О 2. Над знаками химических элементов проставляют валентность: 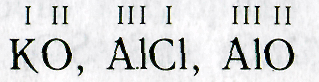
3. Определяют наименьшее общее кратное чисел, выражающих валентность обоих элементов:
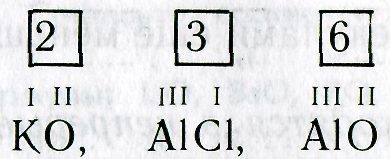
4. Делением наименьшего общего кратного на валентность соответствующего элемента находят индексы (индекс «1» не пишут):

В названии веществ, образованных элементами с переменной валентностью , пишут в скобках цифру, показывающую валентность данного элемента в этом соединении. Например, СuО - оксид меди (II), Сu 2 О - оксид меди (I), и FeCl 2 - хлорид железа (II), FeCl 3 - хлорид железа (III).
Выполните упражнения 4-7 (с. 32-33). Решите задачи 1, 2 (с. 33). §13. Атомно-молекулярное учение
Мы уже знаем, что многие вещества состоят из молекул, а молекулы - из атомов (с. 13-14). Сведения об атомах и молекулах объединяются в атомно-молекулярное учение. Вам известно, что основные положения этого учения были разработаны великим русским ученым М. В. Ломоносовым. С тех пор прошло более двухсот лет, учение об атомах и молекулах получило дальнейшее развитие. Так, например, теперь известно , что не все вещества состоят из молекул. Большинство твердых веществ, с которыми мы встретимся в курсе неорганической химии, имеют немолекулярное строение. Однако
относительные молекулярные массы вычисляются как для веществ с молекулярным, так и для веществ с немолекулярным строением. Для последних понятия «молекула» и «относительная молекулярная масса» употребляют условно. Основные положения атомно-молекулярного учения можно сформулировать так: 1. Существуют вещества с молекулярным и немолекулярным строением.
2. Между молекулами имеются промежутки, размеры которых зависят от агрегатного состояния вещества и температуры.
Наибольшие расстояния имеются между молекулами газов. Этим объясняется их легкая сжимаемость. Труднее сжимаются жидкости, где промежутки между молекулами значительно меньше. В твердых веществах промежутки между молекулами еще меньше, поэтому они почти не сжимаются.
3. Молекулы находятся в непрерывном движении.
Скорость движения молекул зависит от температуры. С повышением температуры скорость движения молекул возрастает.
4. Между молекулами существуют силы взаимного притяжения и отталкивания.
В наибольшей степени эти силы выражены в твердых веществах , в наименьшей - в газах. 5. Молекулы состоят из атомов, которые, как и молекулы, находятся в непрерывном движении.
6. Атомы одного вида отличаются от атомов другого вида массой и свойствами.
7. При физических явлениях молекулы сохраняются, при химических, как правило, разрушаются.
8. У веществ с молекулярным строением в твердом состоянии в узлах кристаллических решеток
(с. 14) находятся молекулы.
Связи между молекулами, расположенными в узлах кристаллической решетки , слабые и при нагревании разрываются. Поэтому вещества с молекулярным строением, как правило, имеют низкие температуры плавления. 9. У веществ с немолекулярным строением в узлах кристаллических решеток находятся атомы или другие ча
c
тицы
(с. 14). Между этими частицами существуют сильные химические связи, для разрушения которых требуется много энергии. Поэтому вещества с немолекулярным строением имеют высокие температуры плавления. Объяснение физических и химических явлений с точки зрения атомно-молекулярного учения.
Физические и химические явления получают объяснение с позиций атомно-молекулярного учения. Так, например, процесс диффузии, знакомый вам из курса физики, объясняется способностью молекул (атомов, частиц) одного вещества проникать между молекулами (атомами, частицами) другого вещества. Это происходит потому , что молекулы (атомы, частицы) находятся в непрерывном движении и между ними имеются промежутки. Сущность химических реакций заключается в разрушении химических связей между атомами одних веществ и в перегруппировке атомов с образованием других веществ.
Ответьте на вопросы 8-12 (с. 33). 1. Что такое валентность химических эле ментов? Поясните это на конкретных примерах.
2. Почему валентность водорода принята за единицу?
3. В реакции железа с соляной кислотой один
атом металла вытесняет два атома водорода. Как это можно объяснить, пользуясь понятием о валентности? 4. Определите валентность элементов по формулам: HgO, K 2 S, B 2 O 3 , ZnO, МnО 2 , NiO, Сu 2 О, SnО 2 , Ni 2 O 3 , SO 3 , As 2 O 5 , CI 2 O 7 . 5. Даны химические символы элементов и указана их валентность. Составьте соответствующие химические формулы:
I II V IV I III VII II III II IV III I LiO, ВаО, РО, SnO, КО, РН, MnO, FeO, BO, HS, NO, CrCI.
6. Пользуясь данными таблицы 3 (с. 30), составьте химические формулы соединений с кислородом следующих химических элементов: Zn, В, Be, Co, РЬ, Ni. Назовите их.
7. Составьте формулы оксидов: меди (I), железа (III), вольфрама (VI), железа (II), углерода (IV), серы (VI), олова (IV), марганца (VII).
8. Изложите сущность основных положений атомно-молекулярного учения.
9. Какие явления подтверждают: а) движение молекул; 6) наличие между молекулами промежутков?
10. Чем отличается движение молекул в газах, жидкостях, твердых веществах?
11. Чем отличаются по своим физическим свойствам твердые вещества с молекулярным и немолекулярным строением?
12. Как объяснить физические и химические явления с точки зрения атомно-молекулярного учения?
1. Вычислите относительные молекулярные массы: а) оксида железа (III); б) оксида фосфора (V); в) оксида марганца (VII).
2. Определите массовые доли элементов в оксиде меди (I) и в оксиде меди (II). Найденные массовые доли выразите в процентах.
1. Что такое валентность химических эле- рода. Как это можно объяснить, пользуясь ментов? Поясните это на конкретных примерах. понятием о валентности? 2. Почему валентность водорода принята 4. Определите валентность элементов по за единицу? формулам: HgO, K 2 S, B2O3, ZnO, МпОг, NiO, 3. В реакции железа с соляной кислотой СигО, БпОг, N12O3, SO 3 , AS2O5, CI2O7. один
атом металла вытесняет два атома водо- 5. Даны химические символы элементов и |
Таблица, созданная известным ученым Д.И.Менделеевым, включает в свой состав все химические элементы и важный сведения о них. Но, чтобы их расшифровать и определять валентность, нужно знать правила работы с этой системой.
Что такое валентность?
Это способность элемента присоединять к себе определенное количество атомов, принадлежащих другому элементу. Именно благодаря таким знаниям можно составлять формулы и совершать химические реакции.
Перед тем, как определить валентность по таблице Д.И.Менделеева, нужно знать, что она может быть постоянной или переменной. Переменную можно вычислить, а постоянную только запомнить.
Представители таблицы с постоянной активностью
- Одновалентные: галогены, водород, щелочные металлы.
- Двухвалентные: щелочные металлы и кислород.
- Трехвалентные: бор и алюминий.
Как определить валентность?
Для этого нужно знать, как устроена таблица Д.И.Менделеева. Каждый элемент этой системы имеет свой номер, по горизонтали располагаются периоды таблицы, а по вертикали – группы. Периоды делятся, в свою очередь, на большие, если состоят из двух рядов, и малые, если ряд только один. Групп всего 8, они распределены неравномерно, поэтому если в ней компонентов много, то она называется главной, а если меньше, то побочная.Чтобы определить валентность элемента, нужно знать его номер и тип, то есть к какой группе он относится. Постоянная величина соответствует номеру главной подгруппы той группы, в которой находится элемент. Видео, как определить валентность по таблице Д.И.Менделеева, поможет разобраться с переменными значениями. Обычно их считают у неметаллов. Вначале определяют номер группы и вычитают это число из 8 (общего количества групп).
Примеры определения и подсчетов
Все щелочные металлы главной подгруппы первой группы имеют постоянную валентность, которая равна 1, щелочно-земельные металлы, располагающиеся во второй группе обладают значением 2.
Немного сложнее определить эту величину у неметаллов, например, серы. Для этого вначале посмотрим, в какой группе она находится, - это 6, постоянное значение равно 6. Для того, чтобы узнать переменное, из 8 вычитаем 6, получается 2. Таким образом, у серы две валентности: постоянная 6 и переменная 2. У галогенов также две величины постоянная 7 и переменная 1 (8-7=1).
Все элементы побочных групп имеют только постоянную цифру, которую можно посмотреть по таблице или запомнить, но обычно ее значение находится в промежутке от 1 до 3.
Если таблица будет в постоянной доступности, то учить постоянную валентность не нужно, но все-таки намного проще запомнить значения распространенных в формулах и реакциях элементах.
Валентность
- число, которое показывает, со сколькими одновалентными атомами может сочетаться атом данного элемента или соединения; сколько таких атомов он может заместить. Валентность характеризует способность атома образовывать определенное количество химических связей , которая может быть связана со способностью атомов отдавать или присоединять определенное число электронов .
Степени валентности элемента является количество атомов водорода (или другого одновалентного элемента), которую атом данного элемента может присоединить или заместить. Так, в соединениях HCl, H 2 O
и хлор является одновалентным, кислород - двухвалентным, а азот - трехвалентным, ибо они соединены соответственно с одним, двумя и тремя атомами водорода.
Валентность химического элемента можно определять не только по формуле его соединения с водородом, но и с другими элементами, валентность которых известна. Например, в соединениях NaCl, MgCl 2 и AlCl 3 натрий является одновалентным, магний - двухвалентным, а алюминий - трехвалентным, ибо они соединены соответственно с одним, двумя и тремя атомами одновалентного хлора.
Некоторые элементы имеют постоянную валентность, а некоторые - переменную. Например, Водород , Натрий и Калий в своих соединениях бывают только одновалентные, Кальций , Барий , Магний , Цинк и Кислород - только двухвалентные, а Бор и Алюминий - только трехвалентный. Большинство химических элементов имеют переменную валентность. Так, медь может быть одновалентная (CuCl) и двухвалентного (CuCl 2), железо - двухвалентное (FeCl 2) и трехвалентное (FeCl 3), углерод - двухвалентный (CO) и четырехвалентный (CO 2), сера - четырехвалентный (SO 2) и шестивалентного (SO 3) и т. д.
Что касается природы валентности, то есть природы тех сил, которые обусловливают собой химическую связь атомов в молекулах, то она долгое время оставалась неизвестной. Только когда стала известна строение атомов, появились теории, которые объясняли причину различной валентности химических элементов и природу химической связи их атомов. Важнейшими из этих теорий является теория о електровалентний, или ионный химическая связь и теория о ковалентная , или атомный, химическая связь.
1. Постоянная валентность
o H, F, Li, Na, K, Rb, Cs, Fr, Ag, I, Cl, Br - 1
o Be, Mg, Ca, Ba, Zn, Ra, Cd, Sr, В - 2
o С, Si - 4. Al, Cr, Bi - 3
2. Переменная валентность
o Fe, Co, Ni - 2 и 3
o Sn, Pb - 2 и 4
o Mn - 2, 3, 4, 5 и 7
o N - 2, 3, 4, 5
Часто люди слышат слово «валентность», не до конца понимая, что это такое. Так что такое валентность? Валентность - один из терминов, которые употребляются в химическом строении. Валентность, по сути, определяет возможность атома образовывать химические связи. Количественно валентность - это число связей, в которых участвует атом.
Что такое валентность элемента
Валентность - это показатель способности атома присоединить другие атомы, образовав с ними, внутри молекулы, химические связи. Число связей атома равно числу его неспаренных электронов. Эти связи называют ковалентными.
Неспаренный электрон - это свободный электрон на внешней оболочке атома, который соединяется в пары с внешним электроном иного атома. Каждая пара таких электронов называется «электронной», а каждый из электронов - валентным. Так определение слова «валентность» - это количество электронных пар, с помощью которых один атом связан с другим атомом.
Валентность схематично можно изобразить в структурных химических формулах. Когда это не нужно, используют простые формулы, где валентность не указана.
Максимальная валентность химических элементов из одной группы периодической системы Менделеева равна порядковому номеру этой группы. Атомы одного и того же элемента могут иметь разную валентность в разных химических соединениях. Полярность ковалентных связей, которые образуются, при этом не учитывается. Вот почему валентность не имеет знака. Также валентность не может быть отрицательной величиной и равняться нулю.
Иногда понятие «валентность» приравнивают к понятию «степень окисления», но это не так, хотя иногда эти показатели действительно совпадают. Степень окисления - это формальный термин, который обозначает возможный заряд, который бы атом получил, если его электронные пары перешли бы к более электрически отрицательным атомам. Тут степень окисления может иметь какой то знак и выражена в единицах заряда. Этот термин распространен в неорганической химии, ведь в неорганических соединениях тяжело судить о валентности. И, наоборот, в органической химии используют валентность, потому что молекулярное строение имеет большая часть органических соединений.
Теперь Вы знаете, что такое валентность химических элементов!

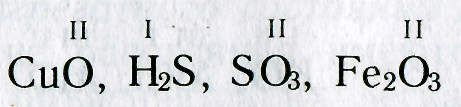 . Пишут химическую формулу вещества и отмечают валентность известного элемента.
. Пишут химическую формулу вещества и отмечают валентность известного элемента.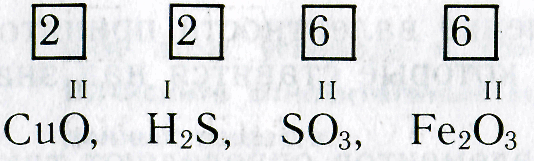
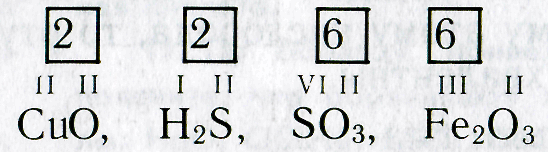 . Вычисляют и проставляют над химическими знаками валентность другого элемента. Для этого общее число валентностей делят на индекс этого элемента:
. Вычисляют и проставляют над химическими знаками валентность другого элемента. Для этого общее число валентностей делят на индекс этого элемента: