Молярная масса молекулы. Молекулярная масса это
Состав простых и сложных веществ химики всего мира отражают очень красиво и лаконично в виде химических формул. Химические формулы - это аналоги слов, которые записывают с помощью букв - знаков химических элементов.
Выразим с помощью химических символов состав самого распространённого вещества на Земле - воды. В молекулу воды входят два атома водорода и один атом кислорода. Теперь переведём это предложение в химическую формулу, используя химические символы (водорода - Н и кислорода - О). Число атомов в формуле запишем с помощью индексов - цифр, стоящих внизу справа от химического символа (индекс 1 для кислорода не пишут): Н 2 0 (читают «аш-два-о»).
Формулы простых веществ водорода и кислорода, молекулы которых состоят из двух одинаковых атомов, записывают так: Н 2 (читают «аш-два») и 0 2 (читают «о-два») (рис. 26).
Рис. 26.
Модели молекул и формулы кислорода, водорода и воды
Чтобы отразить число молекул, используют коэффициенты, которые пишут перед химическими формулами: например, запись 2СО 2 (читают «два-цэ-о-два») означает две молекулы углекислого газа, каждая из которых состоит из одного атома углерода и двух атомов кислорода.
Аналогично записывают коэффициенты, когда указывают число свободных атомов химического элемента. Например, нам нужно записать выражение: пять атомов железа и семь атомов кислорода. Делают это следующим образом: 5Fe и 7О.
Размеры молекул, а тем более атомов настолько малы, что их невозможно рассмотреть даже в лучшие оптические микроскопы, дающие увеличение в 5-6 тысяч раз. Их невозможно рассмотреть и в электронные микроскопы, дающие увеличение в 40 тысяч раз. Естественно, что ничтожно малому размеру молекул и атомов соответствуют и ничтожно малые их массы. Учёные рассчитали, например, что масса атома водорода равна 0,000 000 000 000 000 000 000 001 674 г, что можно представить как 1,674 10 -24 г, масса атома кислорода равна 0,000 000 000 000 000 000 000 026 667 г, или 2,6667 10 -23 г, масса атома углерода равна 1,993 10 -23 г, а масса молекулы воды равна 3,002 10 -23 г.
Рассчитаем, во сколько раз масса атома кислорода больше массы атома водорода, самого лёгкого элемента:
Аналогично, масса атома углерода больше массы атома водорода в 12 раз:
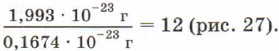
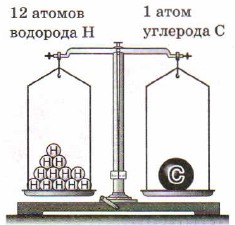
Рис. 27. Масса атома углерода равна массе 12 атомов водорода
Масса молекулы воды больше массы атома водорода в 18 раз (рис. 28). Эти величины показывают, во сколько раз масса атома данного химического элемента больше массы атома водорода, т. е. являются относительными.
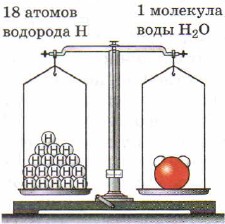
Рис. 27. Масса атома воды равна массе 18 атомов водорода
В настоящее время учёные-физики и учёные-химики придерживаются мнения, что относительная атомная масса элемента - это величина, показывающая, во сколько раз масса его атома больше 1/12 массы атома углерода. Относительную атомную массу обозначают Аr, где r - начальная буква английского слова relative, что означает «относительный». Например, А r (0) = 16, А r (С) = 12, A r (H) = 1.
Каждый химический элемент имеет своё значение относительной атомной массы (рис. 29). Значения относительных атомных масс химических элементов указаны в соответствующих им клетках таблицы Д. И. Менделеева.

Рис. 29.
Каждый элемент имеет свое значение относительной атомной массы
Аналогично, относительную молекулярную массу вещества обозначают М r , например М r (Н 2 0) = 18.
Относительная атомная масса элемента А r и относительная молекулярная масса вещества М r - величины, которые не имеют единиц измерения.
Чтобы узнать относительную молекулярную массу вещества, не обязательно делить массу его молекулы на массу атома водорода. Нужно просто сложить относительные атомные массы элементов, образующих вещество, с учётом числа атомов, например:
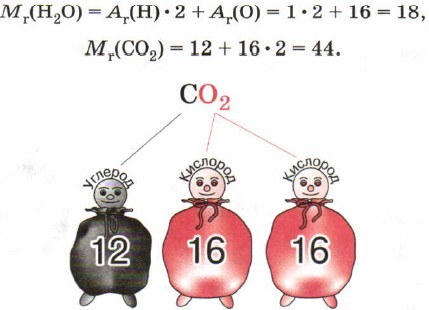
Химическая формула содержит важную информацию о веществе. Например, формула С0 2 показывает следующую информацию:
Рассчитаем массовые доли элементов углерода и кислорода в углекислом газе СO 2 .
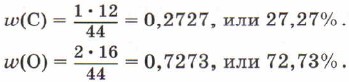
Ключевые слова и словосочетания
- Химическая формула.
- Индексы и коэффициенты.
- Относительная атомная масса (А r).
- Относительная молекулярная масса (М r).
- Массовая доля элемента в веществе.
Работа с компьютером
- Обратитесь к электронному приложению. Изучите материал урока и выполните предложенные задания.
- Найдите в Интернете электронные адреса, которые могут служить дополнительными источниками, раскрывающими содержание ключевых слов и словосочетаний параграфа. Предложите учителю свою помощь в подготовке нового урока - сделайте сообщение по ключевым словам и словосочетаниям следующего параграфа.
Вопросы и задания
- Что означают записи: 3Н; 2Н 2 O; 5O 2 ?
- Запишите формулу сахарозы, если известно, что в состав её молекулы входят двенадцать атомов углерода, двадцать два атома водорода и одиннадцать атомов кислорода.
- Используя рисунок 2, запишите формулы веществ и рассчитайте их относительные молекулярные массы.
- Какой форме существования химического элемента кислорода соответствует каждая из следующих записей: 3O; 5O 2 ; 4СO 2 ?
- Почему относительная атомная масса элемента и относительная молекулярная масса вещества не имеют единиц измерения?
- В каком из веществ, формулы которых SO 2 и SO 3 , массовая доля серы больше? Ответ подтвердите расчётами.
- Вычислите массовые доли элементов в азотной кислоте HNO 3 .
- Дайте полную характеристику глюкозы С 6 Н 12 0 6 , используя пример описания углекислого газа С0 2 .
Это отношение массы молекулы ma химического соединения к 1/12 массы атома углерода С+12: Mr = ma/(1/12mc) = (12ma)/mc. Относительная молекулярная масса является безразмерной величиной.Таблица Д. И. Менделеева поможет определить относительную молекулярную массу, округляя значения атомных масс до двух–трех значащих цифр. Относительную атомную массу обозначают Ar, ее значение указано в таблице элементов Менделеева под химическим знаком элемента.Относительная молекулярная масса вещества равна сумме относительных атомных масс всех элементов (с учетом индексов). Итак,как вычислить относительную молекулярную массу, например, молекулы воды (H2O): Mr (воды) = 2Ar (H) + Ar (O) ≈ 2·1+16 = 18Относительная молекулярная масса воды равна 18 и это значит, что масса молекулы воды больше в 18 раз, чем 1/12 массы атома C+12.
Смесь это чередующиеся друг с другом в пространстве два или более веществ. При этом свойства компонентов смести остаются неизменными. Как найти массу смеси? Масса смеси равна сумме масс компонентов, из которых состоит смесь. mсм = m1 + m2+….. mi. Плотность смеси ρ(cм) смеси, состоящей из i компонентов и занимающей объем V, определяется по формуле:ρ (см)= m/V =(m1+m2+…+mi)/V = m1/V + m2/V +…+ mi/V = ρ1 + ρ2 +…+ ρiгде m1, m2,………..mi; и ρ1,ρ2,…..ρi - массы и плотности каждого из компонентов смеси.Плотности компонентов смеси определяют по справочникам.Масса смеси m равна ρсмV = (ρ1 + ρ2 +…+ ρi)V
Вещества состоят из молекул, молекула мельчайшая частица данного вещества. А как определить массу молекулы? Массу одной молекулы вещества можно определить делением молярной массы вещества на число молекул в одном моле, то есть на число Авогардо. Следовательно m0 = M/NA. Молярная масса численно совпадает с молекулярной, но отличается по размерности. Ее размерность г/моль.Например, молярная масса воды равна 18 г/моль.Чтобы узнать массу молекулы воды, разделим 18 на число Авогадро NA = 6,022×10^23:18/(6,022×10^23) = 2,99·10^-23.Действуя аналогичным образом легко найти массу молекулы вещества с известной химической формулой.
Вещества могут существовать в нескольких состояниях - твердом, жидком и газообразном. Газы постоянно меняют форму и объем. Как рассчитать массу газа? Уравнение состояния газа связывает термодинамические параметры, характеризующие газ – давление p, объем V и температуру Т:рV = (m/M)RT,где m – масса газа, M – молярная масса, R – универсальная газовая постоянная. Массу газа можно определить, если известны параметры состояния: m = pVM/RT.Универсальная газовая постоянная обозначаемая R, равна 8,314 Дж/(К.моль) или 1,987 кал/(К.моль). Это универсальная постоянная - фундаментальная физическая константа.
Растворы - однородная многокомпонентная система, состоящая из растворителя,растворённых веществ и продуктов их взаимодействия. Как определить массу раствора? Найти массу раствора, можно используя формулу нахождения массы раствора:m (раствора) = m (вещества) + m (расворителя). Растворы встречаются повсюду. Например, раствор углекислого газа (CO2) в воде это всем знакомая газированная вода. Одно из важнейших свойств воды - ее способность растворять различные вещества. Растворы могут быть и газообразные, но именно жидкие смеси в химии называют просто растворами. Вода является наиболее часто применяемым неорганическим растворителем.
В килограммах.
Чаще пользуются безразмерной величиной М отн -относительной
молекулярной массой: М отн =M x /D, где М х -масса
x, выраженная в тех же единицах массы (кг, г или др.), что и
D. Молекулярная масса характеризует среднюю массу с учетом изотопного состава всех
элементов, образующих данное хим. соединение. Иногда молекулярную массу определяют для смеси
разл. в-в известного состава, напр. для "эффективную" молекулярную массу
можно принять равной 29.
Абс. массами удобно
оперировать в области физики субатомных процессов и , где путем измерения
энергии частиц, согласно теории относительности, определяют их абс. массы. В
и хим. технологии необходимо применять макроскопич. единицы измерения
кол-ва в-ва. Число любых частиц ( , электро
нов
или мысленно выделяемых в в-ве групп частиц, напр. Na +
и Сl - в кристаллич. решетке NaCl), равное
N А = 6,022 . 10 23 , составляет макроскопич.
единицу кол-ва в-ва-моль. Тогда можно записать: М отн = M x . N A /(D . N A),T.е.
относительная молекулярная масса равна отношению массы в-ва к N A D.
Если в-во состоит из с между составляющими их ,
то величина M x . N A представляет
собой м о л я рн у ю м а с с у этого в-ва, единицы измерения к-рой кг-моль (киломоль,
кМ). Для в-в, не содержащих , а состоящих из , или радикалов,
определяется ф о р-м у л ь н а я м о л я р н а я м а с с а, т.е. масса N A
частиц, соответствующих принятой формуле в-ва (однако в СССР часто и в этом
случае говорят о молекулярной массе, что неверно).
Ранее в использовали
понятия , грамм-ион, теперь-моль , подразумевая под этим N A ,
и соотв. их молярные массы, выраженные в граммах или килограммах. Традиционно
употребляют в качестве синонима термин "молекулярный (молярный) ",
т. к. определение массы производится с помощью . Но, в отличие от ,
зависящего от географич. координат, масса является постоянным параметром кол-ва
в-ва (при обычных скоростях движения частиц в условиях хим. р-ций), поэтому
правильнее говорить "молекулярная масса".
Большое число устаревших
терминов и понятий, касающихся молекулярной массы, объясняется тем, что до эры космич. полетов
в не придавали значения различию между массой и , к-рое обусловлено
разностью значений ускорения своб. падения на полюсах (9,83 м. с -2)
и на экваторе (9,78 м. с -2); при расчетах силы тяжести
() обычно пользуются средним значением, равным 9,81 м. с -2 .
Кроме того, развитие понятия (как и ) было связано с исследованием
макроскопич. кол-в в-ва в процессах их хим. () или физ. ()
превращений, когда не была разработана теория строения в-ва (19 в.) и предполагалось,
что все хим. соед. построены только из и .
Методы определения.
Исторически первый метод (обоснованный исследованиями С. Канниццаро и А.
Авогадро) предложен Ж. Дюма в 1827 и заключался в измерении плотности газообразных
в-в относительно водородного , молярная масса к-рого принималась первоначально
равной 2, а после перехода к кислородной единице измерений молекулярных и атомных
масс-2,016 г. След. этап развития эксперим. возможностей определения молекулярной массы заключался
в исследовании и р-ров нелетучих и недиссоциирующих в-в путем измерения
коллигативных св-в (т. е. зависящих только от числа растворенных частиц) - осмотич.
(см. ), понижения , понижения точки замерзания
()и повышения точки ()р-ров по
сравнению с чистым р-рителем. При этом было открыто "аномальное"
поведение .
Понижение
над р-ром зависит от молярной доли растворенного в-ва (): [(р
- р 0)/р] = N, где р 0 -давление
чистого р-рителя, р-давление над р-ром, N- молярная
доля исследуемого растворенного в-ва, N = (т х /М х)/[(т х /М х)
+ (m 0 /M 0)], m x и М х -соотв.
навеска (г) и молекулярная масса исследуемого в-ва, m 0 и М 0 -то
же для р-рителя. В ходе определений проводят экстраполяцию к бесконечно разб.
р-ру, т.е. устанавливают
для р-ров исследуемого в-ва и для р-ров известного (стандартного)
хим.
соединения. В случае и используют зависимости соотв.
Dt 3 = Кс и Dt к = Еc, где Dt 3 -понижение
т-ры замерзания р-ра, Dt к - повышение т-ры р-ра, К
и Е-соотв. криоскопич. и эбулиоскопич. постоянные р-рителя, определяемые
по стандартному растворенному в-ву с точно известной молекулярной массой, с-моляльная
исследуемого в-ва в р-ре (с = М х т х. 1000/m 0).
Молекулярную массу рассчитывают по ф-лам: М х = т х К. 1000/m 0 Dt 3
или
М х
= т х Е. 1000/m 0 Dt к.
Методы характеризуются достаточно высокой точностью, т.к. существуют спец.
(т. наз. ), позволяющие измерять весьма малые изменения т-ры.
Для определения молекулярной массы используют
также изотермич. р-рителя. При этом р-ра исследуемого в-ва вносят
в камеру с насыщ. р-рителя (при данной т-ре); р-рителя конденсируются,
т-ра р-ра повышается и после установления вновь понижается; по изменению
т-ры судят о кол-ве выделившейся теплоты , к-рая связана с молекулярной массой растворенного
в-ва. В т. наз. изопиестич. методах проводят изотермич. р-рителя в
замкнутом объеме, напр. в Н-образном . В одном колене находится
т. наз. р-р сравнения, содержащий известную массу в-ва известной молекулярной массы (молярная
C 1), в другом-р-р, содержащий известную массу исследуемого
в-ва (молярная С 2 неизвестна). Если, напр., С 1
> С 2 , р-ритель перегоняется из второго колена в первое, пока
молярные в обоих коленах не будут равны. Сопоставляя объемы полученных
изопиестич. р-ров, рассчитывают молекулярную массу неизвестного в-ва. Для определения молекулярной массыы
можно измерять массу изопиестич. р-ров с помощью Мак-Бена, к-рые представляют
собой две чашечки, подвешенные на пружинках в закрытом стеклянном ; в
одну чашечку помещают исследуемый р-р, в другую-р-р сравнения; по изменению
положения чашечек определяют массы изопиестич. р-ров и, следовательно, молекулярную массу
исследуемого в-ва.
Осн. методом определения атомных и мол. масс летучих в-в является . Для исследования смеси соед. эффективно использование хромато-масс-спектромет-рии. При малой интенсивности пика мол.
Молеку-лярная масса — одна из важнейших характеристик вещест-ва. Это понятие тесно связано с определением молекулы.
Для условных структурных частиц (формульных единиц) немолекулярных веществ применяют понятие «формульная масса».
Массы структурных единиц вещества очень малы. Поэто-му для них используют относительные массы.
Относительную молекулярную массу обозначают M r .
Относительную формульную массу немолекулярных ве-ществ также обозначают M r .
Величины относительных молекулярных масс широко используют в разных химических, физических и химико-технических расчетах. Поэтому важно уметь их вычислять.
Вычисление относительной молекулярной массы веще-ства по ее химической формуле. По химической формуле ве-щества можно не только охарактеризовать его состав, а и вы-числить относительную молекулярную массу или (для немо-лекулярных соединений) относительную формульную массу.
Относительная молекулярная масса состоит из отно-сительных масс атомов, которые входят в молекулу, с учетом их количества.
Пример. Вычислим относительную молекулярную массу серной кислоты H 2 SO 4 (рис. 9.1). Относительная масса моле-кулы серной кислоты состоит из суммы относительных масс двух атомов водорода, одного атома серы и четырех атомов кислорода:
M r (H 2 SO 4) = 2A r (H) + A r (S) + 4А r (0);
M r (H 2 SO 4) = 2 . 1 + 32 + 4 . 16 = 98.
Таким же образом вычисляют и относительные формуль-ные массы немолекулярных веществ.
Пример. Вычислим относительную формульную массу фторида кальция CaF 2 (рис. 9.2). Относительная масса фор-мульной единицы фторида кальция состоит из суммы относи-тельных масс катиона кальция Са 2+ и двух анионов фтора F — :
M r (CaF 2) = A r (Ca) + 2A r (F); M r (CaF 2) = 40 + 2 . 19 = 78.
 |
| Рис. 9.3. Состав и строение уваровита |
Часто химические формулы веществ содержат скобки. Например, состав минерала уваровита описывает химичес-кая формула Ca 3 Cr 2 (SiO 4) 3 . Уваровит — ионный кристалл (рис. 9.3). Относительную массу его формульной единицы можно вычислить так: Материал с сайта
M r (Ca 3 Cr 2 (SiO 4) 3) = 3А r (Са) + 2A r (Cr) + 3;
M r (Ca 3 Cr 2 (SiO 4) 3) = 3 . 40 + 2 . 52 + 3(28 + 4 . 16) = 500.
Обрати внимание : индексы, стоящие в химической формуле за скобками, произносят так — дважды, трижды и т. д.
В состав напитка «Кока-кола» входят вода Н 2 O, углекислый газ С O 2 , угольная Н 2 С O 3 и фосфорная Н 3 Р O 4 кислоты, сахаро-за (сахар) С 12 Н 22 O 11 , кофеин C 8 H 10 N 4 O 2 .
На этой странице материал по темам:



