Белки и их структурная организация в клетке. Интегрированный урок химия-биология «Что наша жизнь-белки
Ферментами называют катализаторы белковой природы, которые способны ускорять определенные химические реакции в клетке. Ферменты найдены практически у всех живых организмов. Их способность не только ускорять, но и согласовывать во времени и пространстве несколько тысяч химических превращений, определяет интенсивность и направленность всего обмена веществ на уровне клеток, тканей, органов и организма в целом.
Живая клетка содержит 1000 различных ферментов, каждый из которых осуществляет ту или иную реакцию и таким образом обеспечивает большое разнообразие метаболических превращений.
Первым ферментом полученным в кристаллическом виде стала уреаза, катализирующая реакцию гидролитического расщепления мочевины, до углекислого газа и аммиака.
Сейчас выделено несколько сотен ферментов и более чем у 200 из них изучена первичная, вторичная и третичная структура.
Ферменты катализируют превращение субстрата в новое соединение
Фермент снижает энергию активации, за счет этого реакция ускоряется.
Энергия активации – разница между средним энергетическим уровнем молекул и энергетическим уровнем реакции. Чем больше энергия активации, тем медленнее идет химическая реакцияБиологическая функция фермента, как и любого белка, обусловлена наличием в его структуре активного центра, участка поверхности молекулы фермента, взаимодействующего с молекулой субстрата.
В активном центре различают:
участок связывания, в котором субстрат при помощи нековалентных связей взаимодействует с ферментом, формируя фермент-субстратный комплекс.
каталитический участок – участвует в химическом преобразовании субстрата.
Формируется за счет радикалов 2-3 аминокислот, расположенных в разных местах полипептидной цепи фермента, но пространственно сближенных между собой за счет изгибов этой цепи.
Специфичность – наиболее важное свойство ферментов, определяющее их биологическую значимость. Различают субстратную и каталитическую специфичность.
Субстратная (абсолютная – уреаза (гидролиз мочевины), аргиназа (расщепление аргинина до орнитина и мочевины)
Групповая (панкреатическая липаза и протеолитические ферменты, осуществляющие гидролиз липидов и белков).
Стереоспецифичность к Д-сахарам, к L-аминокислотам, к цис-транс изомерам.
Каталитическая специфичность – превращение присоединенного субстрата к ферменту. Это свойство обеспечивается строением каталитического участка активного центра фермента.
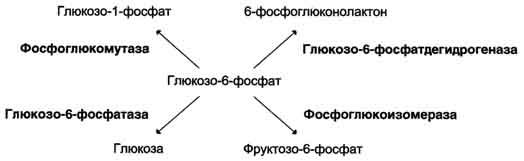
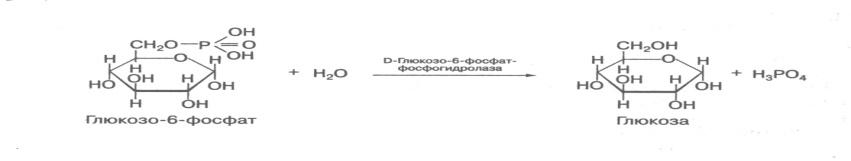
Молекула глюкозо-6-фосфата – субстрат 4 различных ферментов: фосфоглюкомутазы (превращение глюкозо-1-фосфата в глюкозо-6-фосфат) ,
глюкозо-6-фосфатазы (образование глюкозы из глюкозо-6-фосфата), фосфоглюкоизомеразы (глюкозо-6-фосфат превращается во фруктозо-6-фосфат)
глюкозо-6-фосфатдегидрогеназы (образование клеточного НАДФ-H из НАДФ +).
Все ферменты делят на 6 классов:
Оксидоредуктазы
Трансферазы
Гидролазы
Изомеразы
Лиазы (синтазы)
Лигазы (синтетазы
1. Оксидоредуктазы – ускоряют ОВР.
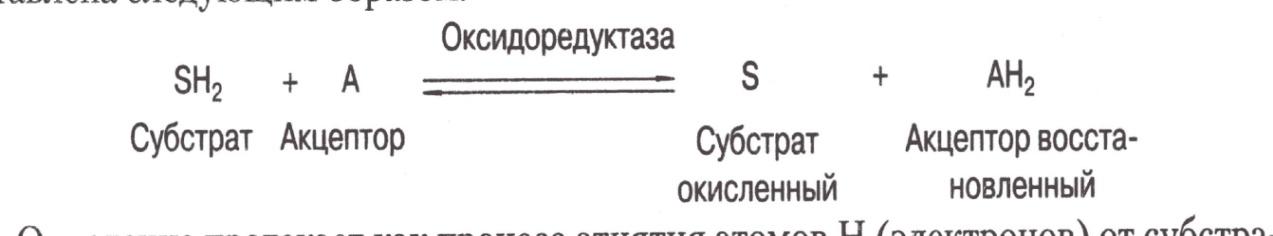
Окисление протекает как процесс отнятия атомов Н (электронов) от субстрата, а восстановление – как присоединение атомов Н (электронов) к акцептору.
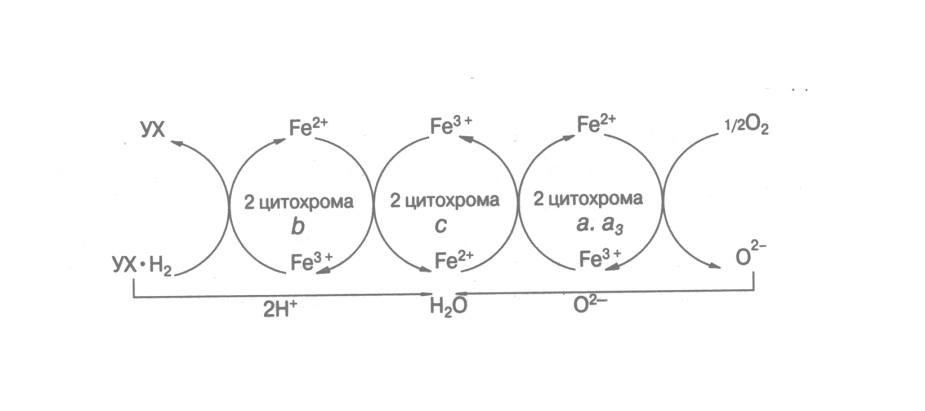
Характерной особенностью деятельности оксидоредуктаз в живой клетке является их способность образовывать системы, в которых осуществляется ступенчатый перенос атомов водорода или электронов от первичного субстрата к конечному акцептору, которым является, как правило, кислород, так что в результате образуется вода.
Если фермент катализирует реакцию отнятия Н непосредственно от окисляемого вещества (первичного субстрата), то его называют первичной дегидрогеназой.
Если фермент катализирует снятие Н со вторичного субстрата, который получил атомы Н при посредстве первичной дегидрогеназы (вторичным субстратом может быть кофермент самой первичной оксидоредуктазы), его называют вторичной дегидрогеназой.
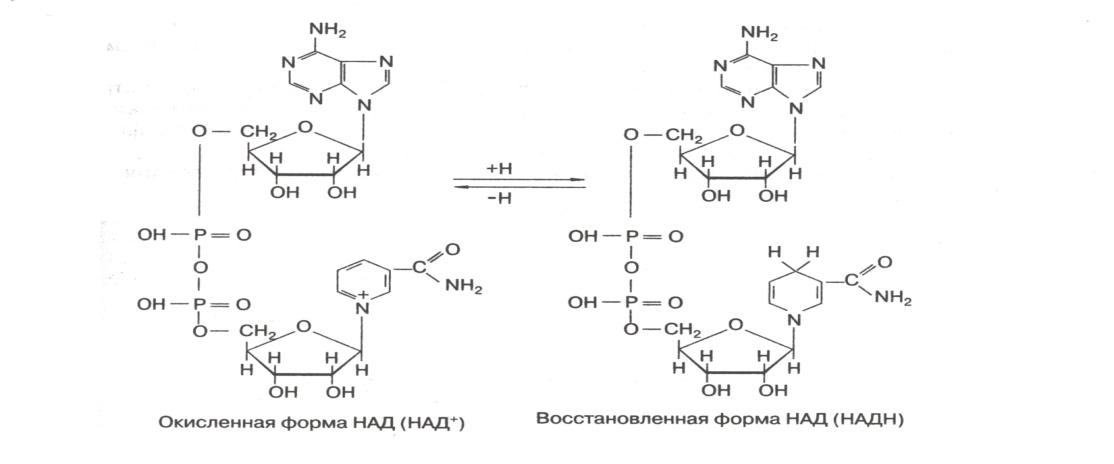
НАД+-зависимая алкогольдегидрогеназа.
Непосредственно к НАД от молекулы спирта переходит один атом Н в виде гидридного иона (Н-), т.е. атома водорода, несущего дополнительный электрон. Второй атом водорода, отнимаемый от молекулы спирта, теряет электрон, превращаясь в протон (Н+), и поступает в реакционную среду.
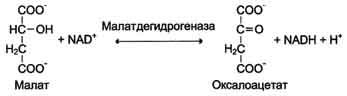
В качестве кофермента, кроме НАД+, ферменты содержат никотинамидаденинуклеотидфосфат (НАДФ+). Этот кофермент является производным НАД+, у которого водород ОН-группы 2-го углеродного атома рибозы аденозина замещен на остаток фосфорной кислоты.
Кофактором восстановленных ферментов в оксидоредуктазной цепи служат флавопротеины. Так флавопротеином является флавинадениндинуклеотид (ФАД)
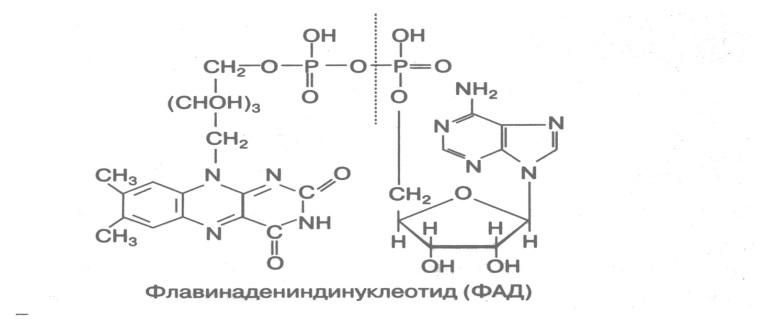
Самый распространенный вариант ОВР в клетке состоит в окислении атомов Н, снятых с субстрата, при посредстве цитохромной системы.
Цитохромная система способна принимать электроны, снятые с атомов Н восстановленного убихинона. Она передает электроны далее по цепи цитохромов и на кислородный атом, который соединяется с Н и образует молекулу воды. Цитохромы в качестве простетических групп содержат железопорфирины.
2. Трансферазы – ферменты, ускоряющие перенос функциональных групп от одного соединения к другому. Самый обширный класс и насчитывает около 500 ферментов.
В зависимости от характера переносимых групп различают
аминотрансферазы,
фосфотрансферазы,
гликозилтрансферазы,
ацилтрансферазы.
Аминотрансферазы – ускоряют реакцию переаминирования аминокислот с кетокислотами. Очень важны для синтеза аминокислот. Аминотрансферазы двухкомпонентные ферменты, простетической группой является пиридоксальфосфат.
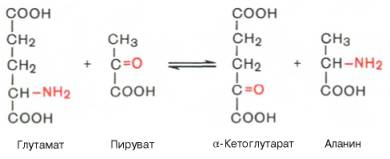
Глутамат: пируватаминотрансфераза
Фосфотрансферазы – переносят остаток фосфорной кислоты.
Эта реакция имеет важное значение для жизнедеятельности организмов, обеспечивающая превращение органических соединений в фосфорные эфиры, обладающие повышенной химической активностью и более легко вступающие в последующие реакции.
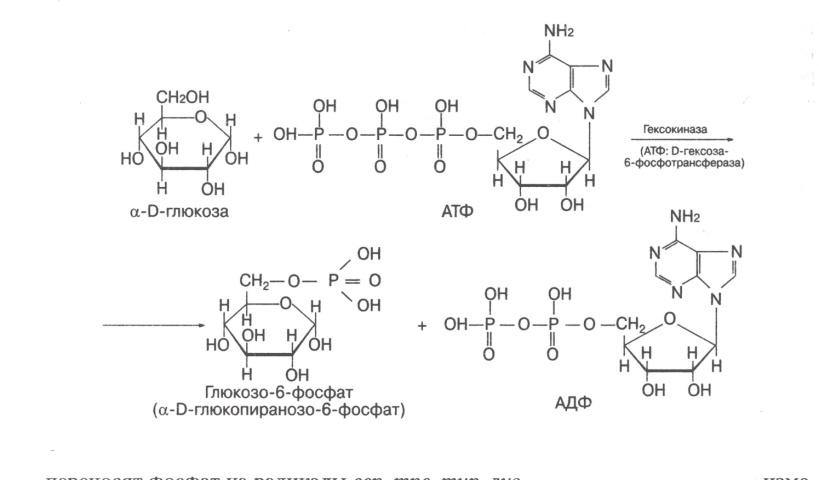
Донором фосфатных остатков является АТФ
Гексокиназа, ускоряющая перенос остатка фосфорной кислоты от молекулы АТФ к глюкозе.
Протеинкиназы–фосфотрансферазы, обеспечивающие перенос фосфорного остатка с АТФ на белки (на радикалы сер, тре, тир). Это в свою очередь усиливает обмен веществ.
Гликозилтрансферазы ускоряют реакции переноса гликозильных остатков из молекул фосфорных эфиров к молекулам моно или полисахаридов.
Процесс переноса гликозильных остатков на фосфорную кислоту называют фосфоролизом, т.к. формально он аналогичен гидролизу, но вместо воды по месту разрыва кислородного мостика присоединяются водород и фосфатная группа фосфорной кислоты.
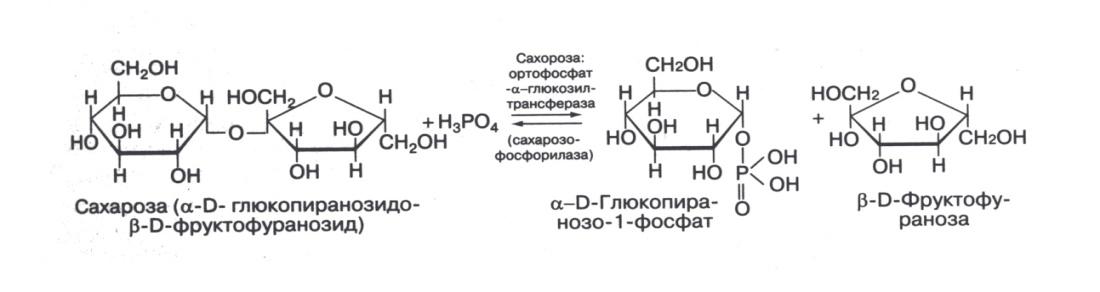
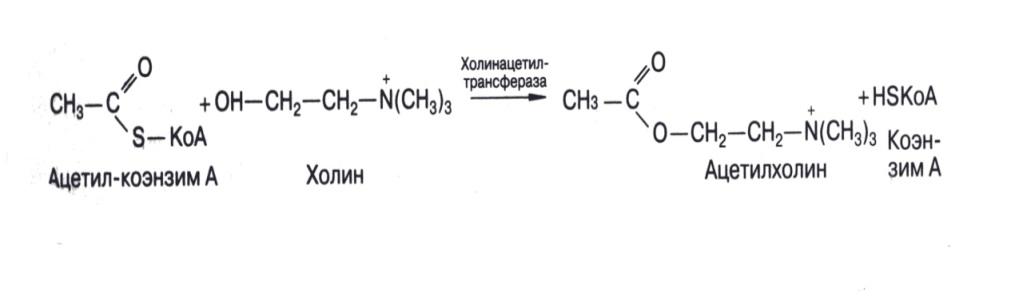
Ацилтрансферазы ускоряют перенос остатков карбоновых кислот на аминокислоты, амины, спирты. Универсальным источником всех ацильных групп является ацил-коэнзим А. СоА соединяется с ацетильным остатком, который занимает место водорода в его HS-группе и образует ацетил-СоА, который служит кофактором в реакции переноса, соответствующих групп.
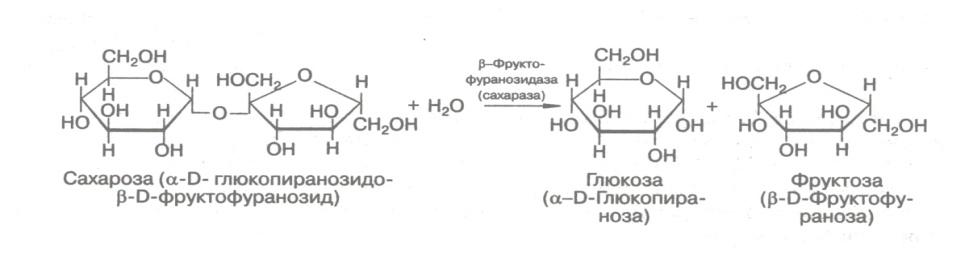
3. Гидролазы – ферменты, ускоряющие реакции расщепления органических соединений при участии воды. Эстеразы – ферменты, катализирующие реакции гидролиза и синтеза сложных эфиров; гликозидазы, ускоряющие разрыв гликозидных связей; фосфатазы и пептидгидролазы, катализирующие гидролиз фосфоангидридных и пептидных связей; амидазы, ускоряющие разрыв амидных связей, отличных от пептидных.
1. Фосфатазы обладают субстратной специфичностью.
2. В зависимости от того, на какой пространственный изомер (α или β) действует фермент гликозидаза, его относят к α -или β-гликозидазам. Т.е. гликозидазы обладают ярко выраженной пространственной специфичностью.
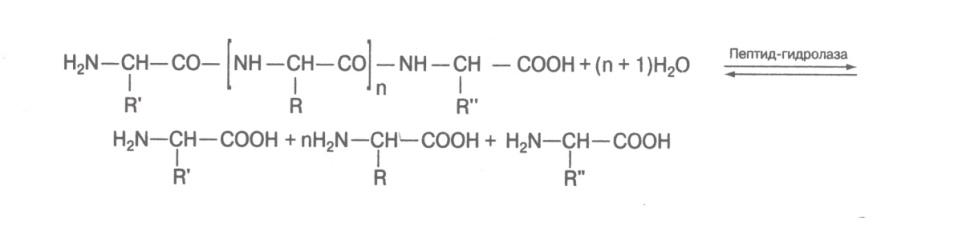
3. Пептид-гидролазы (протеиназы), ускоряющие реакции гидролиза пептидных связей в белках и пептидах.
Протеиназы в зависимости от механизма их действия на пептидные связи делят на:
сериновые протеиназы , несущие в активном центре радикалы сер и гис (химотрипсин и трипсин)
тиоловые (цистеиновые) протеиназы, имеющие в активном центре радикал цис
кислые протеиназы , имеющие оптимум рН ниже 5 и содержащие радикалы дикарбоновых аминокислот (пепсин)
Пептид-гидролазы, катализирующие гидролиз пептидов до свободных аминокислот, могут отщеплять последние от пептида, начиная либо с аминокислоты, обладающей свободной NH 2 -группой (аминопептидазами ), либо аминокислоты, имеющей свободную СООН-группу (карбоксипептидазами ).
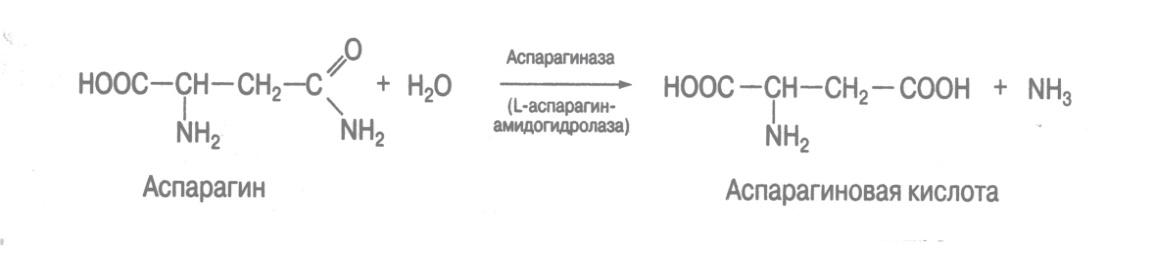
4. Амидазы ускоряют гидролиз амидов кислот. Из них важную роль в биохимических процессах в организме играют уреаза, аспарагиназа и глутаминаза.
4. Лиазы. Ферменты, ускоряющие реакции распада органических соединений по связям (С-С, С-N, C-O). При этом замыкаются двойные связи и выделяются СО 2 , Н 2 О, NH 3 .
С-С лиаза (углерод-углерод) - декарбоксилаза

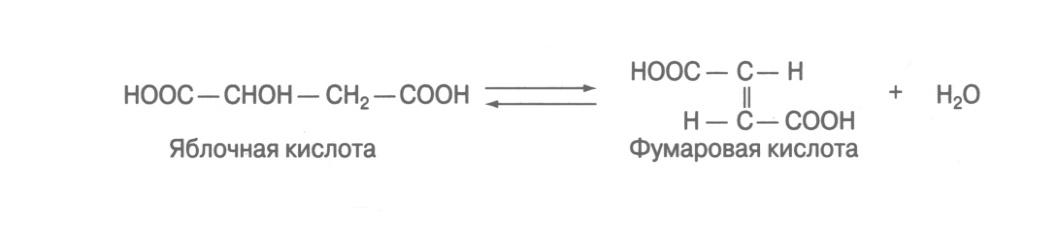
С-О лиаза (углерод-кислород) - гидролиаза, ускоряющая реакции гидратирования и дегидратирования органических соединений. Например, аспартаза, катализирующая реакцию прямого дезаминирования аспарагиновой кислоты.
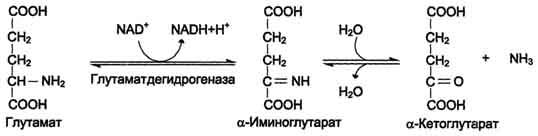
С- N лиаза (углерод-аммиак) - фермент катализирует обратимую
реакцию превращения L-глутаминовой кислоты в
α-кетоглутаровую .
5. Изомеразы ускоряют изменения в пределах одной молекулы. Эти изменения состоят во внутримолекулярном переносе водорода, фосфатных и ацильных групп, в изменении пространственного расположения атомных группировок, в перемещении двойных связей


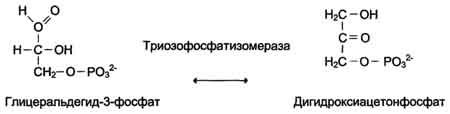
6. Лигазы (синтетазы) – главная их особенность – сопряженность синтеза с распадом веществ, способных поставлять энергию для осуществления биосинтетического процесса. Одним из таких соединений является АТФ. При отрыве от ее молекулы в присутствии лигаз одного или двух концевых остатков фосфорной кислоты выделяется большое количество энергии. Лигазы же каталитически ускоряют синтез органических соединений из активированных за счет распада АТФ исходных продуктов.
Пируваткарбоксилаза ускоряет реакцию образования щавелевоуксусной кислоты из пировиноградной кислоты и СО 2 .
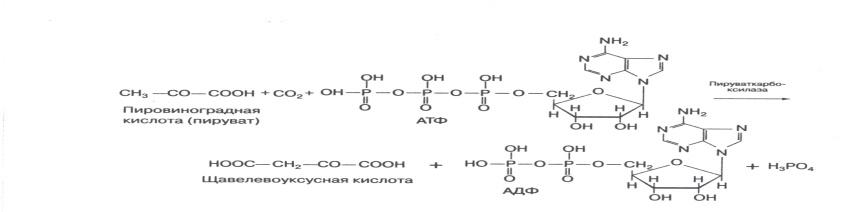
Лигазам, катализирующим синтез С-О связей, принадлежит важнейшая роль в биосинтезе белков, т.к. они ускоряют реакции активирования аминокислот перед вступлением последних в пептидную связь.
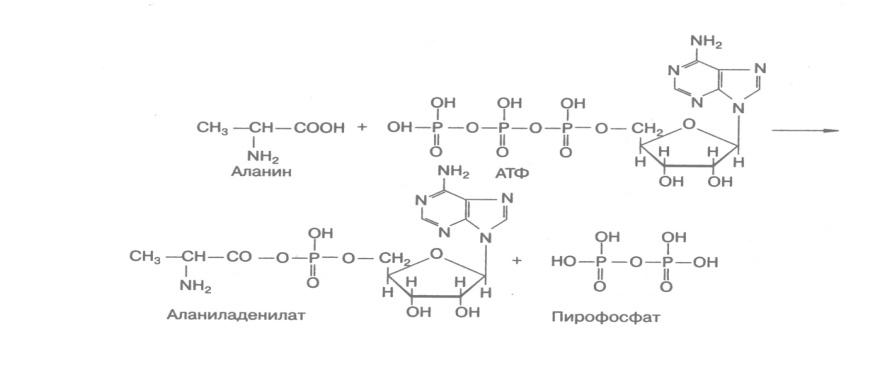
С аминоациладенилатов аминокислоты передаются на тРНК, образуя аминоацил-тРНК, которые используются при синтезе полипептидов.
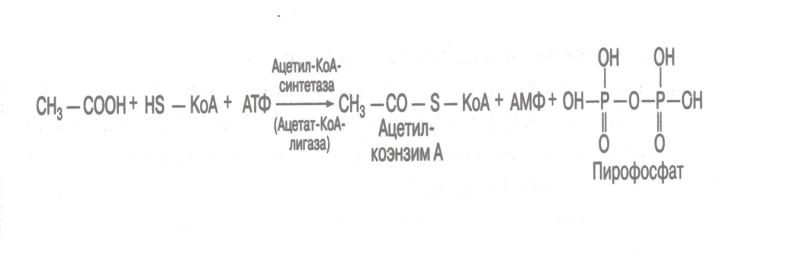
Лигазы могут ускорять реакции образования C-S связей, являясь ацил-коэнзим А-синтетазами. Пример образования ацетил-коэнзима А из уксусной кислоты и коэнзима А.

Ферментами называются белковые вещества (см. Белки), ускоряющие жизненно важные химические реакции в клетках организмов. Являясь катализаторами, они образуют с исходными веществами неустойчивые промежуточные соединения: эти соединения, распадаясь, дают конечный продукт данной реакции и освобождают ферменты.
Действие некоторых ферментов легко наблюдать в опыте. Так, фермент каталаза значительно ускоряет разложение пероксида водорода Н2О2 на воду и кислород. Это жизненно важная реакция, так как пероксид водорода образуется в результате обмена веществ в клетке и сам по себе оказывает на клетку вредное действие. Каталаза содержится почти во всех клетках животных и растительных организмов.
Известно очень много ферментов, и каждый из них ускоряет только одну какую-либо реакцию или группы однотипных реакций. Эту особенность ферментов называют специфичностью или селективностью (избирательностью) действия. Направленность их действия позволяет организму быстро и точно выполнять сложную химическую работу по перестройке молекул пищевых веществ в нужные ему соединения.
Уже во рту во время пережевывания пищи под влиянием фермента амилазы сложные сахара, в частности крахмал, начинают разлагаться на менее сложные. Эта работа в дальнейшем будет продолжена в кишечнике ферментами карбогидразами. В желудке и кишечнике разложению с участием пепсина, трипсина, химотрипсина подвергаются белки пищи. Жиры разлагаются на глицерин и карбоновые кислоты (или их соли) под влиянием ферментов, называемых липазами. Все эти реакции разложения протекают по одному принципу: разрывается определенная химическая связь в молекуле белка, углевода или жира, и освободившиеся валентности используются для присоединения групп ОН- и иона Н+ из молекул воды. Происходит процесс гидролиза. Для молекулы белка эту реакцию можно представить так:
R 1 -CO-NH-R 2 - + НОН = -R 1 COOH + NH 2 -R 2 -
Известны ферменты, оказывающие иное действие на молекулы. Некоторые из них ускоряют окислительно-восстановительные реакции: они способствуют переносу электрона от одной молекулы (окисляемой) к другой (восстанавливаемой). Существуют ферменты, соединяющие молекулы друг с другом; ферменты, переносящие большие и сложные группы атомов от одной молекулы к другой, и т. д.
Располагая богатым набором ферментов-катализаторов, клетка разлагает молекулы пищевых белков, жиров и углеводов на небольшие фрагменты и из них заново строит белковые и иные молекулы, которые будут точно соответствовать потребностям данного организма. Вот почему великий русский физиолог И. П. Павлов назвал ферменты носителями жизни.
Активность большего числа ферментов определяется строением белковой молекулы. Определенное пространственное расположение остатков аминокислот, образующих цепеобразную молекулу белка (полипептидная цепь, см. Пептиды), создает условия для протекания катализируемой ферментом реакции. Длинная цепочка остатков аминокислот свернута в сложный клубок так, что аминокислоты, расположенные в цепи далеко друг от друга, могут оказаться соседями. Некоторые из возникших таким путем группировок остатков аминокислот проявляют каталитические свойства и образуют активный центр фермента.
Пепсин, химотрипсин, принимающие участие в пищеварении, могут служить примером ферментов, в которых активная группа является частью молекулы белка.
Другие ферменты для проявления активности нуждаются в веществах небелковой природы - так называемых кофакторах. Кофактором может быть ион металла (цинка, марганца, кальция и др.) или молекула органического соединения; в последнем случае ее часто называют коферментом. Иногда для действия фермента бывает необходимо присутствие как ионов металлов, так и коферментов. В отдельных случаях кофермент очень прочно соединен с белком; это наблюдается, например, у фермента каталазы, где кофермент представляет собой комплексное соединение железа (гем). В некоторых ферментах коферменты - это вещества, близкие по строению молекулы к витаминам. Витамины, таким образом, являются предшественниками коферментов. Так, из витамина В1 (тиамина) в клетках образуется тиамин-пирофосфат - кофермент важного фермента (его называют декарбоксилаза), превращающего пиро-виноградную кислоту в оксид углерода (IV) и ацетальдегид; из витамина В2 получаются коферменты флавиновых ферментов, осуществляющих в клетках перенос электронов - одну из стадий окисления пищевых веществ; из витамина В12 образуются коферменты, необходимые в процессе кроветворения, и т. д.
В последние годы широко используются так называемые иммобилизованные (неподвижные) ферменты. Для ускорения нужной реакции их закрепляют на поверхности инертного «носителя». В качестве его обычно используют силикагель - пористую белую массу, по составу - оксид кремния (IV) -или полимерные материалы. Через эту массу фильтруют исходные вещества. Фермент быстро и точно производит высокоспецифичную «химическую работу», в результате которой получаются продукты, почти не содержащие посторонних соединений.



Маршрутный лист
Задание №1
| Особенности | |
| 1) первичная структура |
|
| 2) вторичная структура |
|
| 3) третичная структура |
|
Задание №2
Задание №3
А) Фрагмент одной из цепей ДНК имеет следующую структуру ЦЦГААТТГАГГЦТТА.Определите последовательность нуклеотидов в и-РНК и последовательность АК в молекуле белка
Б)
Вопросы для группы биологов
1 -й этап
1.За какие процессы отвечают белки?
2.Что служит поставщиками белков?
3.Перечислите некоторые белки и укажите в состав чего они входят (по презентации)
3 -й этап
Рассказ о функциях белков (по презентации)
Вопросы для группы биохимиков
1-ый этап
1.Кто из ученых определил,что белки состоят из аминокислот?
2.Сколько насчитывается а/к в клетках и тканях,и сколько их являются компонентами белка?
3.Какие бывают аминокислоты?
4.Формула а/к с рассказом о фнкциональных группах(выведу на экран)
5.Реакция образования пептидной связи (выведу на экран),кто впервые осуществил такую реакцию?
6.Определение белков(с позиции биополимеров)
7.Рассказ о структурах белка и о связях,их поддерживающих(по презентации и наглядности)
4 -й этап
Рассказ о синтезе белков(по презентации)
Биологические задачи (для всех групп)
На рубашке осталось пятно от мясного соуса. Почему даже после его кипячения с биопорошком пятно осталось?
Почему свежие пятна крови на одежде нельзя отстирать в горячей воде?
Почему при массовом выпадении и хрупкости волос врачи косметологи прописывают принимать серусодержащие препараты?
Подумайте, почему для того, чтобы получить вкусный бульон. Мясо кладут в холодную воду, а для вкусного мяса его опускают в кипяток?
Почему в инструкции к стиральным порошкам с биологически активными добавками пишут, что средства не рекомендуется применять для стирки изделий из натуральной шерсти?
Вопросы для группы химиков
2 -й этап
1.Физические свойства белков(по консистенции,по отношению к воде) с примерами.(по презентации)
2.Химические свойства белков:
А)гидролиз
Б)горение
В)денатурация -видеоэксперимент
Г)ренатурация
Д)высаливание
3.Качественные реакции на белки-демонстрация
4.Пути использования знаний о химических свойствах белков(презентация)
Биологические задачи (для всех групп)
На рубашке осталось пятно от мясного соуса. Почему даже после его кипячения с биопорошком пятно осталось?
Почему свежие пятна крови на одежде нельзя отстирать в горячей воде?
Почему при массовом выпадении и хрупкости волос врачи косметологи прописывают принимать серусодержащие препараты?
Подумайте, почему для того, чтобы получить вкусный бульон. Мясо кладут в холодную воду, а для вкусного мяса его опускают в кипяток?
Почему в инструкции к стиральным порошкам с биологически активными добавками пишут, что средства не рекомендуется применять для стирки изделий из натуральной шерсти?
Задание для группы диетологов
5-й этап
На долю… животного происхождения должно приходиться 60% рациона школьника.
Потребностям растущего детского организма в наибольшей степени соответствует … белок, поэтому молоко и молочные продукты, обязательный, не подлежащий замене продукт. Суточная норма 500мл.
Самыми важными ростовыми АК являются лизин, триптофан,и гистидин, поэтому важно, чтобы в рационе школьника были их источники- ….
Школьникам стоит … жареное, копчёное, колбасные изделия.
В рыбе много …, который улучшает правильное усвоение (а не накопление) жиров.
Важным дополнением … части рациона являются орехи и бобовые.
Надо помнить, что потребности в … гораздо меньше, чем в других питательных веществах. Потребляя больше … пищи, мы нарушаем кислотно-щелочной баланс (в желудке будет больше выделяться кислоты), что может привести к расстройству всей пищеварительной системы.
Проведённые исследования говорят о вреде … диеты. … диета за неделю даёт потерю до 5 кг веса. Но это потеря не веса, а всего лишь воды, да, и, то временная. На каждый грамм углеводов в организме приходится 4г воды. Окрылённые первыми результатами, вы рано или поздно из-за энергетического дефицита, вернётесь к употреблению углеводов и наберёте прежний вес, а то ещё и прибавите.
Биологические задачи (для всех групп)
На рубашке осталось пятно от мясного соуса. Почему даже после его кипячения с биопорошком пятно осталось?
Почему свежие пятна крови на одежде нельзя отстирать в горячей воде?
Почему при массовом выпадении и хрупкости волос врачи косметологи прописывают принимать серусодержащие препараты?
Подумайте, почему для того, чтобы получить вкусный бульон. Мясо кладут в холодную воду, а для вкусного мяса его опускают в кипяток?
Почему в инструкции к стиральным порошкам с биологически активными добавками пишут, что средства не рекомендуется применять для стирки изделий из натуральной шерсти?
Высказывания
1.Жизнь-это способ существования белковых тел.(Ф.Энгельс)
2. Жить — значит чувствовать и мыслить, страдать и блаженствовать, всякая другая жизнь — смерть.(В. Белинский)
3. Жить надо так, чтобы хотелось повторить.(Б. Крутиер)
4.Жизнь-прекраснейшая из выдумок природы.(И.Гете)
5. Жизнь — это битва, и надо готовиться к ней с самого детства.(А. Моруа)
6. Жизнь — это высокоустойчивое состояние вещества, использующее для выработки сохраняющих реакций информацию, кодируемую состояниями отдельных молекул (А.А Ляпунов)
7. Жить — это бороться, бороться — это жить.(П. Бомарше)
|
|
|
|
|
|
|
|
Интегрированный урок (химия + биология) по теме
«Что наша жизнь…? Белки!»
Эпиграф урока:
«Жизнь - прекраснейшая из выдумок природы»(И.Гёте)
Цели урока:
Образовательная:
Расширить и обобщить знания учащихся о природных высокомолекулярных веществах - белках.
Раскрыть ведущую роль белков в строении и жизнедеятельности клетки. Познакомить учащихся с основными химическими свойствами белков на основе проведения опытов и компьютерной презентации; рассмотреть этапы синтеза белка в клетке и обосновать их роль в живом организме.
Развивающая:
Развитие мышления через формирование причинно- следственных связей между строением, свойствами и функциями белков.
Развитие общеучебных умений и навыков.
Развитие познавательного интереса и творческих способностей.
Воспитательная:
Формировать научное мировоззрение учащихся на примере интеграции естественных наук, лежащих в основе строения и функционирования организма.
Воспитание сознательного отношения к здоровому образу жизни
Воспитание трудолюбия, настойчивости.
Ориентировать на сознательный выбор профессии, акцентируя внимание на молекулярную биологию и медицину.
Задачи урока:
Учащиеся должны обобщить знания о химических свойствах белков, этапы синтеза белка в клетке и роль белков в живом организме.
Уметь применять полученные знания при проведении качественных реакций на белки в лабораторных исследованиях, и выполнении упражнений по данной теме.
Тип урока : урок -рефлексия
Форма работы : Работа в группах.
Оборудование и материалы :
модель молекулы белка (бусы - первичная структура, спирально закрученный телефонный шнур - вторичная структура, клубок буклированных ниток - третичная; 4 клубка, прошитых лентой - четвертичная),
таблица генетического кода,
персональный компьютер, медиа-проектор, презентация (слайд-шоу),
таблички с названиями групп (лабораторий).
План урока:
1. Содержание белков в организме. Строение и структура белков.
2. Свойства белков. Качественные реакции.
3. Функции белков.
4. Биосинтез белка.
5. Значение белков в питании школьников и спортсменов.
Тема, эпиграф выведены на экран через проектор.
Учащиеся делятся на группы - лаборатории :
Биохимиков
Химиков
Биологов
Диетологов
Планируемый конечный результат (с позиции компетентностей, формируемых у школьников):
Предметные УУД
1.Знать состав, строение и основные функции белков
2.Знать отличия белков от других классов соединений.
3. Знать,как проводить анализ вещества, используя соответствующие методики.
Метапредметные УУД
1.Уметь пользоваться дополнительной литературой и сайтами Интернета с целью получения необходимых знаний.
2. Уметь самостоятельно выполнять задания различного уровня сложности.
Личностные УУД
1.Уметь вести диалог, аргументировано обосновывать свою точку зрения.
Ход урока.
Учитель
Здравствуйте,коллеги! Попрошу вас произвольно разделиться на 4 группы-лаборатории.Мы начинаем нашу совместную работу лабораторий естественных наук. Итак,нам предстоит ознакомиться с работой лабораторий: биологов, химиков, биохимиков и диетологов.
Этап мотивации
Обратите внимание на экран - здесь даны высказывания известных авторов.Ваша задача-выбрать 3 наиболее подходящих друг другу по смыслу.У вас на столах карточки с номерами высказываний.Каждая группа обсуждает и приклеивает к доске при помощи двустороннего скотча карточки с ниаболее подходящими,по их мнению, по смыслу высказываниями. (Слайд1)
Подвожу итог.
Просмотр видео
Итак,тема нашего интегрированного урока-«Что наша жизнь?-Белки!» (Слайд 2)
Учитель Давайте подумаем,а что мы можем вспомнить о белках?Какие их характеристики?(строение свойства и т.д.).Какие же цели нашего урока? (Слайд 3)
Целью урока является повторение и систематизация знаний по строению, свойствам, функциям, биосинтезу белков в организме. Практической составляющей урока является связь белкового питания со здоровьем человека.
Учитель Прохождение этапов урока отражено разнообразными заданиями в индивидуальных маршрутных листах,которые лежат на ваших столах.Кроме того,на ваших столах лежат задания,которые вам необходимо выполнить.Ознакомтесь,пожалуйста.
1 этап.
Учитель
Итак,рассказ лаборатории биологов
Из органических веществ, входящих в состав клетки на первом месте по значению и количеству стоят белки.
1 . Без белков невозможно представить такие жизненно важные процессы организмов как: питание, дыхание, рост, способность к передвижению.
2. Поставщиками белков служат мясо, молоко, рыба, творог, рыба, орехи и бобовые.
3. Важнейшие белки - это:
Коллаген - компонент соединительной ткани костей, сухожилий и хрящей;
Кератин - белок кожи, перьев, рогов, волос, ногтей
Гемоглобин переносит кислород к клеткам
Фибриноген - предшественник фибрина при свёртывании крови
Миозин входит в состав подвижных нитей миофибрилл мышц
Инсулин регулирует обмен глюкозы
Яичный альбумин - белок куриного яйца
Трипсин катализирует гидролиз белков (слайд 4)
Рассказ лаборатории биохимиков
1. Русский учёный академик Данилевский определил, что белки состоят из АК. В клетках и тканях насчитывается 170 АК, а в составе белков обычными компонентами считают только 20 АК.
2. 9 АК являются незаменимыми, т.е не могут быть синтезированы организмом, поступают с пищей. К ним относятся: аланин, аргинин, аспарагин, глицин, гистидин, глутамин, глутаминовая кислота, изолейцин и лейцин.
3. Белковые молекулы образуют только -АК
R ─ CH ─ COOH
│
NH 2
4. Чтобы разобраться как АК соединяются между собой в макромолекулы вспомним о функциональных группах АК.
NH 2 ─ CH ─ COOH
│
аминогруппа карбоксильная группа
↓ ↓
основные свойства кислотные свойства
АК - амфотерные органические соединения, т.к проявляют как кислотные, так и основные свойства. Для строительства макромолекул белков важно отметить наличие двух реакционных центров.
Впервые такую реакцию осуществил Эмиль Герман Фишер в 1902 году. 18 АК удалось соединить в молекулу, по свойствам напоминающую белок.
5. Сформулируем вывод:
Первичная структура - это полипептидная цепь линейной формы из последовательно соединенных пептиднойс вязью - АК.
Теперь можно дать определение белкам:
Белки - природные полимеры, состоящие из остатков - АК.
Вторичная структура возникает за счёт скручивания первичной структуры в спираль или гармошку за счёт водородных связей между соседними витками или звеньями. Водородные связи образуются между пептидными участками белковой молекулы, делая цепочку более устойчивой.
В пространстве закрученная в спираль полипептидная цепь образует третичную структуру белка, которая поддерживается взаимодействием различных функциональных групп:
а) дисульфидных мостиков-S-S-
б) сложноэфирных мостиков - гидрофобные связи
в) солевых - ионных связей
По форме встречаются глобулярные («клубок» - шар) и фибриллярные (нить) белки.
Третичная структура белка во многом обуславливает специфическую биологическую активность белковой молекулы.
Четвертичная структура белка представляет собой объединение нескольких глобул с третичной структурой в единый конгломерат. Например, 4 крупных макромолекулы в гемоглобине связаны между собой катионами железа. (Слайды 5-12)
Учитель
Выполните в маршрутных листах задание №1 по структурам белка. На выполнение задания отводится 2 минуты.
Установите соответствие между особенностями и уровнем организации белковой молекулы
| Особенности | Уровень организации белковой молекулы |
| А) определяет форму, свойства и функции белка | 1) первичная структура |
| Б) специфическая конфигурация, имеющая вид клубка | 2) вторичная структура |
| В) имеет вид спирали или «гармошки» | 3) третичная структура |
| Г) прочность структуры обеспечивают водородные связи | |
| Д) линейная последовательность аминокислот | |
| Е) прочность структуры обеспечивается ионными, водородными и дисульфидными связями |
2 этап.
Учитель химии:
Строение белков очень сложное. Если эти вещества такие уникальные по своей природе, то возможно и их свойства, будут какие - то особенные? Послушаем, что расскажет нам по этому поводу лаборатория химиков.
Рассказ о физических и химических свойствах белков учеников лаборатории химиков.
Физические свойства белков:
1) Есть твёрдые - это белки костей и хрящей и жидкие - яичный белок
2) Одни хорошо растворимы в воде, образуя коллоидные растворы (желатин, белок молока), а другие нерастворимые (мышечные волокна и клейковина злаков). (слайд 13)
В зависимости от структуры белки проявляют различные химические свойства.
1. Первое химическое свойство белков, которое позволило установить состав белков - это их способность подвергаться гидролизу. Изучением реакций гидролиза занимался русский учёный академик Данилевский. Посмотрите на запись уравнения гидролиза в тетради по химии. Какие продукты образуются в результате реакции гидролиза? (АК). (слайд 14)
В нашем организме реакции гидролиза протекают постоянно. Следует подчеркнуть особую роль ферментов в этих реакциях.
За 1минуту фермент каталаза расщепляет 5 миллионов молекул пероксида водорода. Без катализатора реакция протекала бы несколько недель.
2. При горении белков ощущается характерный запах «жжёных перьев». Эта реакция позволяет отличить натуральную шерсть и шёлк. 15
3. Механическое воздействие, высокая температура, УФ лучи, радиоактивное излучение, кислоты, щелочи, соли тяжёлых металлов приводят к денатурации белков - разрушению вторичной, третичной и четвертичной структур. Ренатурация белка - процесс восстановления структуры белковой молекулой. 16
Денатурация будет необратимой, если разрушена первичная структура белка.
4. При обработке поваренной солью белки высаливаются. Этот процесс обратим. Если взять стеклянной трубочкой небольшое количество осадка и поместить в воду, то вновь получим раствор белка (демонстрация). 17
5. Качественные реакции на белки
Ксантопротеиновая.
Биуретовая. (Видео)
Знания химических свойств белков используют в хлебопечении, сыроварении, дублении кожи, пивоварении, пищевой промышленности (для умягчения мяса при получении полуфабрикатов, производства «готовых» каш).
Динамическая пауза
Поднимите левую руку вверх - это аминогруппа АК.
Поднимите правую руку вверх - это карбоксильная группа АК.
Хлопните в ладошки - образовался биполярный ион.
Поздоровайтесь с соседом справа - образовался дипептид. Сколько пептидных связей?
Поздоровайтесь с соседом слева - образовался дипептид. Сколько пептидных связей
Правой рукой создайте волнообразное движение - вторичная структура белка.
Наклоните голову вперёд, сведите плечи - произошла денатурация.
Поднимите голову, расправьте плечи - произошла ренатурация.
3 этап.
Учитель
Лаборатория биологов раскроет ведущую роль белков в процессах жизнедеятельности клетки всех живых организмов. (Слайды 17-22)
Рассказ о функциях белков учеников лаборатории биологов.
Учитель биологии:
В течение всей своей жизни каждый организм синтезирует свои собственные белки. Белки в организме постоянно обновляются. И это их свойство лежит в основе обмена веществ.
Выполните задание №2 в маршрутных листах
Тест по теме «Функции белков»
1. Регулирует обмен глюкозы в организме:
1. актин 2. инсулин 3. тубулин 4. -глобулин
2. Назовите функцию, которую выполняет основная масса белков семян растений и яйцеклеток животных:
1. защитная 2. структурная 3. накопительная 4. двигательная
3.Трипсин, входящий в состав сока поджелудочной железы, выполняет функцию
1. защитную 2. структурную 3. ферментативную 4. двигательную
4. Какую функцию в клетке НЕ выполняют белки:
1. транспортную 2. каталитическую 3. защитную 4. запасающую
5. Как называется белок, выполняющий структурную функцию?
1. коллаген 2. актин 3. миозин 4. пепсин
6. Какой из перечисленных белков выполняет транспортную функцию?
1. актин 2. -глобулин 3. пепсин 4. гемоглобин
7. Какой белок участвует в образовании тромба при ранениях?
1. коллаген 2. кератин 3. фибрин 4. миозин
8. Какой белок является противовирусным?
1. фибриноген 2. интерферон 3. фибрин 4. актин
9. Какую функцию выполняют актин и миозин?
1. защитную 2. транспортную 3. рецепторную 4. двигательную
10. Какие вещества ускоряют химические реакции в клетке?
1. гормоны 2. витамины 3. ферменты 4. ингибиторы
4 этап.
Учитель
Белковые молекулы недолговечны. Они постоянно требуются клетке. Важнейшим свойством живой клетки является способность синтезировать белковые молекулы.
Лаборатория биохимико в познакомит с уникальным процессом - возобновления белков в организме.(слайды)
Учитель
Выполните задание №3 в маршрутном листе по сборке фрагмента белковой молекулы. Задание по сборке белковой молекулы за компьютером выполнит учащийся.
Задание по сборке белковой молекулы
1 . Фрагмент одной из цепей ДНК имеет следующую структуру ТЦГГГТААААГЦЦЦТ. Определите последовательность нуклеотидов в и-РНК и последовательность АК в молекуле белка.
2 . Фрагмент одной из цепей ДНК имеет следующую структуру ЦЦГААТТГАГГЦТТА.
Определите последовательность нуклеотидов в и-РНК и последовательность АК в молекуле белка
3 . Фрагмент одной из цепей ДНК имеет следующую структуру ГТГЦЦТААЦЦАТЦЦА. Определите последовательность нуклеотидов в и-РНК и последовательность АК в молекуле белка.
Учитель биологии:
В живых организмах синтез белков происходит очень быстро, иногда почти мгновенно, поэтому учёные настойчиво изучают его механизм. Решение задач синтеза белков является величайшей победой человечества, которая откроет невиданные ресурсы получения разнообразных веществ и материалов для народного потребления и техники.
ХХI век - век молекулярной биологии. И, возможно, удастся решить проблемы долголетия и бессмертия.
5 этап.
Учитель
Лаборатория диетологов
Почему белковой составляющей рациона школьника надо уделять особое внимание?
На долю белков животного происхождения должно приходиться 60% рациона школьника.
Потребностям растущего детского организма в наибольшей степени соответствует молочный белок, поэтому молоко и молочные продукты, обязательный, не подлежащий замене продукт. Суточная норма 500мл.
Самыми важными ростовыми АК являются лизин, триптофан,и гистидин, поэтому важно, чтобы в рационе школьника были их источники - мясо, рыба, яйца, творог, сыр, кальмары, бобовые.
Школьникам стоит ограничить жареное, копчёное, колбасные изделия.
В рыбе много метионина, который улучшает правильное усвоение (а не накопление) жиров.
Важным дополнением белковой части рациона являются орехи и бобовые.
Надо помнить, что потребности в белках гораздо меньше, чем в других питательных веществах. Потребляя больше белковой пищи, мы нарушаем кислотно-щелочной баланс (в желудке будет больше выделяться кислоты), что может привести к расстройству всей пищеварительной системы.
Проведённые исследования говорят о вреде белковой диеты. Белковая диета за неделю даёт потерю до 5 кг веса. Но это потеря не веса, а всего лишь воды, да, и, то временная. На каждый грамм углеводов в организме приходится 4г воды. Окрылённые первыми результатами, вы рано или поздно из-за энергетического дефицита, вернётесь к употреблению углеводов и наберёте прежний вес, а то ещё и прибавите.
Учитель
6 этап
Хочу обратиться с просьбой к сотрудникам лабораторий. Дайте совет хозяйкам, решив биологическую задачу Время на обсуждение - 2 минуты.
Задания:
На рубашке осталось пятно от мясного соуса. Почему даже после его кипячения с биопорошком пятно осталось?
Почему свежие пятна крови на одежде нельзя отстирать в горячей воде?
Почему при массовом выпадении и хрупкости волос врачи косметологи прописывают принимать серусодержащие препараты?
Подумайте, почему для того, чтобы получить вкусный бульон. Мясо кладут в холодную воду, а для вкусного мяса его опускают в кипяток?
5.Почему в инструкции к стиральным порошкам с биологически активными добавками пишут, что средства не рекомендуется применять для стирки изделий из натуральной шерсти?(слайд)
7 этап-рефлексия
Благодарю сотрудников всех лабораторий. Вы убедительно доказали, что понятия жизнь и белки неразделимы.У каждого из вас сложилось впечатление о нашем сегодняшнем уроке.Кому-то очень понравилось,узнали что-то новое,кто-то остался равнодушным,кому-то не понравилось.Приклейте кружочки -аминокислоты на нашу воображаемую белковую молекулу.
8 этап-заключение
На память о нашей встрече эти строки.
Я, так живу, я, размножаюсь, себе подобных создаю;
Всё в организме исправляю, переношу, передаю.
Я защищаю от напасти, а если надо - накажу.
Я в холоде согреть сумею, и от жары тебя спасу.
С азотной кислотой желтею, лиловый биурет даю.
Я, умирая - возрождаюсь, денатурируя - скорблю.
А как водички я напьюсь, то на пептиды распадусь (слайд)
Из белков как из кирпичиков строится организм любого живого существа, в том числе человека.
«Жизнь человека - вот его характер» Иоганн Гёте.
И как белковая молекула складывается из аминокислот, жизнь складывается из ваших поступков. Живите с интересом, и счастливо!(слайд)







