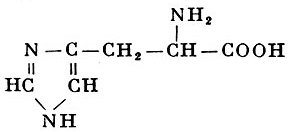
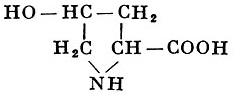
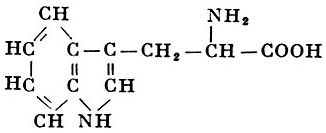
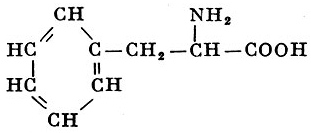
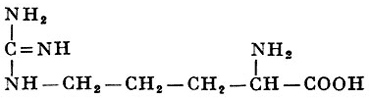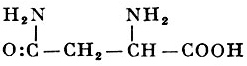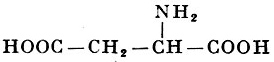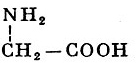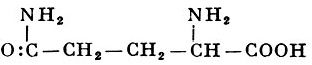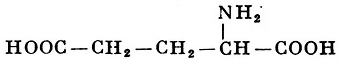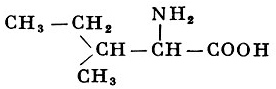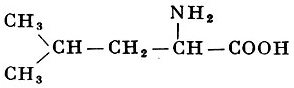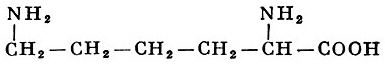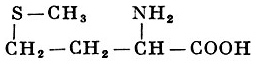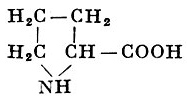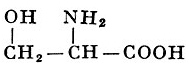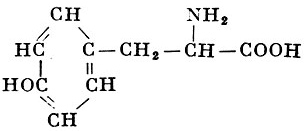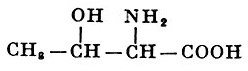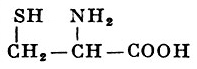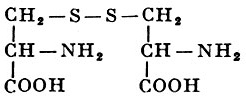Реакции получения аминокислот. Способы получения аминокислот
связанных СН-протонов, а также у протона пептидной группы CO-NH между 6,7 и 9,0 м.д. Резонансная область С2 -протона имидазола гистидина лежит между 8,0 и 9,2 м.д., а NH-индольного протона триптофана между 9,0 и 11,0 м.д.
1.5. Получение аминокислот
Аминокислоты можно получать путем выделения из белковых гидролизатов, с использованием микробиологических методов, с помощью ферментативных методов или путем химического синтеза. Первые три подхода дают ь-аминокислоты, а при химическом синтезе получаются DL-соедине- ния, которые нужно еще разделить на оптические антиподы. До недавнего времени аминокислоты удавалось получить только в очень малых количествах, но в последние годы их производство приняло индустриальные масштабы и в 1977 г. достигло 400 000 т. Аминокислоты используются как вкусовые добавки в пищевой промышленности (глутамат натрия, аспарагиновая кислота, цистин, глицин и аланин), как питательные растворы и терапевтические средства в медицине (все протеиногенные аминокислоты), как добавки для улучшения неполноценных питательных белков и фуража (лизин, метионин, триптофан), как промежуточные вещества в косметической промышленности (серии, треонин, цистеин), а также как исходные вещества для синтеза различных пептидов.
1.5.1. Выделение из белковых гидролизатов
При получении аминокислот белки прежде всего расщепляют с помощью основного, кислотного или ферментативного гидролиза . В классическом методе кислотного гидролиза используют 6 н. НО (1 К11П ПО °С) или 8 н. H2 SO4 . Время реакции от 12 до 72 ч в зависимости от строения белка. Очень устойчивы к гидролизу пептидные связи, образованные лейцином, изолейцином и валином. При этом триптофан разрушается полностью, серии и треонин до 10%,
Потери аминокислот, обусловленные присутствием углеводов, могут быть снижены, если работу проводят в вакууме и применяют большой избыток кислоты (белок: НС1 = 1:10000).
В других методах кислотного гидролиза используют смесь пропионовой кислоты с 12 н. НС1 (время реакции при 160 "С 15 мин, при 130 °С 2 ч), 3 н. 4-толуолсульфокислоту или 3 н. меркаптоэтансульфоновую кисло-Т У (время реакции при 110 °С 24 ч). Последний метод используется специально для аналитических целей. Триптофан при этом сохраняется на 95%.
При щелочном гидролизе с 6 н. раствором гидроксида бария в автоклаве (давление ~ 700 кПа) разрушаются гидроксиаминокислоты и цистеин, в то время как триптофан сохраняется.
Очень легко протекает ферментативный гидролиз белков. Для осуществления полного гидролиза необходимо применение комбинации нескольких ферментов, что связано с высокой специфичностью протеаз. На практике применяют протеиназы животного и бактериального происхождения (эндопептидазы), такие, как трипсин, пепсин и папайи в комбинации со специфическими амино- и карбоксипептидазами . Нередко хорошие результаты получают, используя неочищенный фермент (сырой препарат), например панкреатин, который содержит все пищеварительные ферменты поджелудочной железы (его используют при получении аспарагина и глутамина).
Выделение отдельных аминокислот из белкового гидролизата не сопровождается никакими затруднениями в тех случаях, когда они содержатся в достаточно высоких концентрациях и заметно отличаются друг от друга по свойствам.
Глутаминовая кислота, например, кристаллизуется прямо из концентрированного гидролизата, насыщенного хлористым водородом, цистин и тирозин отделяют благодаря их плохой растворимости в воде. Селективное отделение ароматических аминокислот удается выполнить с помощью адсорбции на активированном угле. Полученную при гидролизе смесь аминокислот лучше всего разделить хроматографически. Выделению отдельных компонентов предшествует обычно разделение на кислые, основные и нейтральные группы аминокислот, при этом большое значение имеют электрофорез и специфические ионообменники. Раннее распространенные методы разделения, такие, как фракционная перегонка эфиров (по Фишеру), экстракция моноаминокарбоновых кислот н-бутиловым или амиловым спиртом (по Дакину), осаждение «гексоновых оснований» лизина, аргинина и гистидина фосфорновольфрамовой кислотой или флавиановой кислотой, теперь имеют только второстепенное значение.
1.5.2. Микробиологические методы
Почти все протеиногенные аминокислоты можно получать с помощью специфических микроорганизмов. Принцип микробиологического метода (ферментации) заключается в аэробном выращивании микроорганизмов в разбавленных питательных растворах, содержащих усвояемые источники углерода и азота, как, например, углеводы, углеводороды, органические и неорганические соединения азота, минеральные соли и ростовые вещества. Можно использовать также полупродукты биосинтеза аминокислот. Например, глутаминовая кислота получается из а-кетоглутаровой кислоты, изолейцин и серии можно получать ферментацией культуры, содержащей треонин или глицин. В качестве микроорганизмов применяются культуры дикого типа, напримерCornynebacterium glutamicum иBrevibacterium flavum, а также мутанты, которые производят большое количество специфических аминокислот.
В случае ауксотрофных мутантов микроорганизмы не располагают некоторыми ферментами, необходимыми для биосинтеза определенных ами-
нокислот. Синтез поэтому может остановиться на одной из первых ступеней или пойти по другому пути. Если продуктом первой ступени или продуктом такого побочного пути являются аминокислоты, то они производятся и аккумулируются в большом количестве, например применение мутанта, дефицитного по гомосерину из Eschrichia coli, обусловливает накопление лизина. Отсутствие гомосериндегидрогеназы блокирует гомосерин- треонин-метиониновый путь синтеза
в пользу побочного синтеза, приводящего к образованию лизина. В случае регуляторных мутантов, применяемых для получения аргинина, метионина, изолейцина и триптофана, «наработка» аминокислот осуществляется путем нарушения механизма обратной связи.
Таблица 1-7. Аминокислоты, полученные ферментацией
Микроорганизмы | Источники С, N | Полученные |
|
аминокислоты |
|||
Глюкоза или гидролизат | |||
крахмала, патока тростникового | |||
и свекловичного сахара, аммиак, | |||
Мутанты Brevibac- | мочевина | ||
Патока тростникового и |
|||
свекловичного сахара, гидролизат | |||
крахмала, м-алканы, уксусная | |||
Мутанты Preudomo- | Этанол, неорганические сое- |
||
nas Irifoli и Е. coli | динения азота | ||
Фумаровая кислота, аммиак | |||
Serratia marcescens | Фенилмолочная кислота | ||
Нефть, нитрат аммония | |||
Фосфаты, сульфат магния, | Lys, Arg, Туг |
||
хлорид марганца(11) | |||
Candida lipopytica, | Хлорид кальция и сульфат | ||
железа(11) в следовых количес- | |||
Особое техническое значение приобрела ферментация глутаминовой кислоты так называемыми микроорганизмами дикого типа. Культивируют бактерии в стерилизованных ферментерах при 35° С, используя в качестве источника углерода глюкозу или патоку и вводя в систему воздух и аммиак. Через 40 ч из культуры можно изолировать глутаминовую кислоту. Выход составляет 50 кг аминокислоты на 100 кг введенной глюкозы. Глутаминовая кислота в форме моноглутамата натрия применяется в значительных количествах как вкусовое вещество и приправа в пищевой промышленности. При незначительной добавке глутамата заметно усиливается и улучшается естественный вкус мясных блюд.
Аминокислоты, полученные ферментативно, представлены в табл. 1-7.
1.5.3. Ферментативные методы
В то время как при ферментации аминокислот присутствуют все ферменты микроорганизмов, при ферментативных синтезах используются изолированные или фиксированные на носителе ферменты для катализа заданного пути реакции. Так, при получении аспарагиновой кислоты путем присоединения аммиака к фумаровой кислоте используют ь-аспартазу, при получении L-аланина из ь-аспарагиновой кислоты - ь-аспартат-/3-декарбоксилазу. Особенно большое значение имеет синтез ь-лизина из D, ь-а-аминокапролак- тама с помощью L-аминокапролактамгидролазы, получаемой микробиологическим путем . В этом синтезе, проводимом как одностадийный процесс, остающийся D-a-аминокапролактам рацемизуется а-аминокапролак-
DL-cx-аминокапропактам -
L-аминокапролактам - а-аминокапролактамрацемаэа гидропаза
D-a-аминокапролактам
тамрацемазой и таким образом в конце концов полностью переводится в
1.5.4. Методы химического синтеза
Известно очень много методов синтеза аминокислот. Ниже остановимся лишь на некоторых: аминолиз галогенкарбоновых кислот, синтез Штрекера, синтезы через азлактоны, гидантоины и шиффовы основания, а также синтезы с. малоновым эфиром. Кроме того, рассматриваются асимметрический и пребиотический синтез, а также биосинтез аминокислот.
1.5.4.1. Аминолиз галогенкарбоновых кислот
Старейший метод синтеза аминокислот - нуклеофильное замещение галогена в легкодоступных галогенкарбоновых кислотах:
R - CHCl(Br) - СООН + NH3 - R - CHNH2 - СООН + NH4 Cl(Br)
Впервые таким путем в 1858 г. был получен глицин из монохлоруксусной кислоты. Выходы составляют 60 - 70%, если применять 10-кратный избыток аммиака и работать в присутствии карбоната аммония. При этом аминогруппа образующейся кислоты дает карбамат аммония R = CH(NH- -СООЫНд), и это предохраняет ее от дальнейшего превращения во вторичные и третичные аминосоединения.
Удобнее использовать реакцию эфиров галогенкарбоновых кислот с фтальимидом калия с последующим расщеплением получающейся фталиламинокислоты кислотным гидролизом или гидразинолизом (синтез Габриэля). В качестве реагента аминолиза применяют также уротропин (Хильман, 1948 г.).
Br-CHR-COOH - » \()\ N-CHA-COOH КВг
1.5.4.2. Синтез Штрекера
Синтез аминокислот, предложенный в 1850 г. Штрекером, основан на присоединении синильной кислоты к карбонильной группе альдегида в присутствии аммиака. Получающийся при этом нитрил а-аминокарбоновой кислоты омыляется далее в DL-аминокислоту:
В качестве побочных продуктов могут получаться иминодинитрилы NH(CHR-CN)2 , тринитрилы и карбоновые кислоты; общий выход при этом синтезе - 75% .
Бухерер внес изменения в синтез Штрекера: альдегид реагирует со смесью цианида натрия и карбоната аммония (или мочевины) и дает легко изолируемый гидантоин, который затем расщепляется щелочным гидролизом:
Синтез Штрекера имеет большое значение для получения в промышленности глутаминовой кислоты, метионина и лизина. Исходные альдегиды получают из продуктов нефтехимического производства, и синтезы обычно ведут через гидантоины. По методу Дюпона исходят из ацетилена:
По методу Аджиномото получают DL-глутаминовую кислоту, исходя из акрилонитрила:
Расщепление рацемата по этому методу происходит самопроизвольной кристаллизацией при затравливании оптически чистыми кристаллами, причем выпавшая в осадок D-глутаминовая кислота после рацемизации снова вводится в процесс. В настоящее время в мире ежегодно производится -250 000 т глутамата натрия, причем большую часть составляет продукт, полученный синтетически.
При техническом синтезе лизина исходят из цианмасляного альдегида, который получают присоединением ацетальдегида к акрилонитрилу:
Промышленное производство DL-метионина (в 1977 г. произведено 100 000 т), который применяется главным образом как добавка в корм скоту, ведется по методу Штрекера из /3-метилмеркаптопропионового альдегида, который получают из акролеина и метилмеркаптана. В этом случае не требуется разделения энантиомеров, так как L- и D-метионин одинаково хорошо усваиваются животными.
1.5.4.3. Азлактонный синтез по Эрлейнмейеру - Плёхлю
Синтез основан на том, что ароматический или а, ^-ненасыщенный алифатический альдегид обрабатывается бензоилглицином (гиппуровая кислота) или ацетилглицином (ацетуровая кислота) в присутствии уксусного ангидрида и ацетата натрия. При этом образуется замещенный азлактон, кото-
рый при нагревании с фосфором и иодоводородной кислотой претерпевает восстановительное расщепление:
1.5.4.4. Гидантоиновый синтез
Альдегиды реагируют с гидантоином (метиленовый компонент) и смесью ацетангидрид - ацетат натрия (конденсирующее средство), давая продукты конденсации, которые после восстановления амальгамой натрия или смесью иодоводорода и фосфора последующим щелочным гидролизом переводятся в аминокислоты.
CH2 -CHNH,-COOH
Вместо гидантоина в качестве соединений с активной метиленовой группой можно использовать также тиогидантоин, 2,5-диоксопиперазин и роданин (тиазолидин-4-он-2-тион).
1.5.4.5. Алкилирование шиффовых оснований
Легкодоступные бензилиденовые производные этилового эфира глицина можно превращать в а-аминокарбанионы действием сильных оснований, таких, как литийдиизопропиламид (ЛДА) или трет-бутипат калия, и затем алкилировать:
CeHj-CH"N-CHR-COOCjHj
HCIHa N-CHR-COOC,H5 (HnH H3N-CHR-COO0 )
Синтезы проходят с выходом - 90% . Повторное металлирование и алкилирование позволяют ввести второй алкильный остаток, что приводит к разветвлению цепи. При использовании шиффова основания, полученного из этилового эфира глицина и бензофенона, алкилирование можно проводить в условиях техники фазового переноса.
1.5.4.6. Синтезы с малоновым эфиром
В синтезе аминокислот этот метод имеет большое значение. Введение боковой цепи происходит путем алкилирования аниона малонового эфира, который образуется в присутствии сильных оснований, например метилата натрия. Наиболее благоприятно протекание реакции через N-ациламинома- лоновый эфир:
COOCJHJ ^ COOCJHJ СООС,Н5
ацеташномалоновый эфир |
|||
СООСа Н5 | |||
CH,CO-NH-Cle | в » CHjCONH-C-R |
||
" Х |
|||
З Н *° : О Н е. | Ha N-C-R | ||
2 CjHgOH | |||
В качестве ацильного остатка кроме ацетильной и формильной групп применяется фтальимидогруппа (Сёренсен, 1903 г.), алкилирующими реагентами служат алкилгалогениды и основания Манниха.
1.5.4.7. Синтез меченых аминокислот
Применение меченых аминокислот значительно расширило наши знания о биохимических функциях аминокислот, пептидов и белков. В зависимости от конкретной задачи синтезируются аминокислоты с одной или несколькими метками, меченные азотом-15, тритием, углеродом-14 и серой-35. Введение тритиевых меток осуществляют методом изотопного обмена или (лучше) прямым химическим синтезом.
В случае изотопного обмена получают препараты с удельной активностью < 10 Ки/ммоль, причем радиоактивные изотопы обычно равномерно распределены по молекуле. Можно проводить восстановление ненасыщен-
ных или галогенированных полупродуктов в присутствии газообразного трития. При этом, например, из 2,4,6-трибром-ь-фенилаланина получается ь-2,4,6-3 Н-фенилаланин с высокой удельной активностью (60 - 80 Ки/ммоль):
CH2 -CH(NHj)COOH восстановитель | |||
Аминокислоты могут быть получены микробиологическими методами, |
|||
если в питательном растворе содержится 14 СО2 | или другие источники |
||
1 4 С | После разрушения клеточной структуры фракции белка изолиру- |
||
и полученную при гидролизе смесь аминокислот разделяют хромато- |
|||
графически. О биосинтезе35 8-ь-метионина с очень высокой удельной активностью сообщили Бретчер и Смит . Для введения 14 С-метки можно использовать прямой химический синтез. Большое применение находит малоновый эфир (синтезы с циануксусным эфиром, содержащим 2-14 С в остатке уксусной кислоты, для С2 -метки и с |4 С-синильной кислотой для Cj-метки). Если исходят из14 СО2 , то сначала из алкилгалогенида, магния и СО2 получают карбоновую кислоту R-14 COOH (реакция Гриньяра), затем с помощью галогенирования и аминолиза ее переводят в аминокислоту. Синтез Штрекера, с K14 CN приводит к метке карбоксильного углерода, с1 5 NH3 - к "^-аминокислотам (имеющим важное значение в исследовательской практике). Классический синтез триптофана с малоновым
эфиром - пример введения метки в положение С3 | (Гейдельберг, 1949 г.): |
|
(CH,)a NH* | ||
СН(СООЩа | C H J - C (C O O H)J |
|
NH-COCH, OHe | ||
ШДр-м с1-триптофан
Производные цистеина и валина, меченные тритием, а также валин с двойной меткой (15 N и2 Н) применялись при исследованиях биосинтеза пенициллина .
1.5.4.8. Асимметрические синтезы
Для стереоспецифического синтеза аминокислот с помощью хиральных реагентов имеются многочисленные возможности. Из них следует упомянуть асимметрическое гидрирование ненасыщенных соединений с хиральными катализаторами - фосфинами родия и рутения или фосфиновыми лигандами, фиксированными на полимере , асимметрическое декарбоксилирование специфических комплексов малоната кобальта (III) при малоновом синтезе, переаминирование а-кетокислот с ь-пролином в качестве хирального реагента и асимметрическое алкилирование шиффовых оснований . Практическое значение асимметрический синтез имеет в том случае, если он приводит к получению ценных, редких аминокислот, если хиральные реагенты не очень дороги или если их можно регенерировать. Проблематичны асимметрические синтезы, протекающие через циангидрины или гидантоины, так как при гидролизе приходится считаться с рацемизацией. Об асимметричном синтезе по методу Штрекера сообщается в работе . Ниже приводится пример асимметрического алкилирования шиффова основания трет-бутилового эфира глицина и гидроксипинанона .
„ »»ЦМ-СНа-СООСН,
аминокислоты получают с оптическим выходом 60 - 80%, гидроксипинанон может быть регенерирован, например, в виде оксима и вновь использован для синтеза.
Практический интерес получил асимметрический синтез L-ДОФА, при котором удалось осуществить стереоспецифическое гидрирование дигидроксикоричной кислоты с помощью катализатора Вилькинсона RhL3 Cl .
Структура оптически активного лиганда L
1.5.4.9. Пребиотические синтезы
В связи с проблемой возникновения жизни на Земле внимание исследователей привлекает вопрос первого синтеза аминокислот. В результате исследований твердо установлено, что рацематы почти всех природных аминокислот могли быть получены в особых энергетических условиях из простых углеродных и азотных соединений.
Абиогенное образование аминокислот происходило не только на Земле. Это было подтверждено хроматографическим анализом мерчисонского метеорита, упавшего в 1969 г. в Австралии. В экстрактах образцов, которых не касалась рука человека нашли 23 рацемические аминокислоты, среди них глицин, глутаминовую кислоту, аланин, валин и пролин (в миллиграммовых количествах), а также саркозин, изовалин, пипеколиновую и аминомасляную кислоты (в следовых количествах).
Аминокислотные анализы водных экстрактов образцов лунного грунта, проведенные в рамках американской программы «Аполлон», показали присутствие глицина и аланина. Еще четыре аминокислоты были обнаружены с помощью газовой хроматографии в кислотном гидролизате экстракта. Это Glu, Ser, Asp, Туг. Спектроскопические данные однозначно показывают присутствие NH3 , НСНО и HCN в космическом пространстве. В лунных пробах также обнаружены исходные продукты для абиогенного образования «внеземных» аминокислот: СН4 , N2 , CO, CO2 , HCN (20 - 70 нг/г). Возможно, правда, что часть предшественников аминокислот происходит от газов земных ракет.
Особое значение при абиогенном синтезе аминокислот имеет, по-видимому, синильная кислота . Исходя из нее, можно легко объяснить синтезы ряда аминокислот в присутствии альдегидов и аммиака (синтез Штрекера). Кроме того, превращения самой HCN тоже могут привести к возникновению различных аминокислот.
(димеризация) | (тримеризация) | (тетрамеризация) |
Новые возможности олигомеризации цианидов рассматриваются в работе . Сообщается также об образовании аминокислот при облучении растворов HCN кобальтом-60 .
При пребиотическом синтезе пептидов могли играть роль конденсационные реагенты, образованные в ходе химической эволюции, такие, как циклические или линейные полифосфаты или ненасыщенные алифатические структуры (например, карбодиимид) .
В работе сообщается об олигомериэации глицина до пентаглицина под влиянием периодической тепловой обработки суспензии гидратированного глинистого материала и глицина. Полиаминокислоты образуются путем термической конденсации при 105 "С без катализаторов .
Большой интерес представляют сообщения о том, что в экстрактах вулканического пепла, собранного в момент извержения, обнаружены некоторые аминокисло-
Таблица 1-8. Аминокислоты,
Исходные
компоненты
СН4 , NHj, H2 , Н2 О
СН4 , NH3 , H2 , H2 S СН4 , СО2 , N2
Глюкоза, NH3 , V2 O5 (H2 O2 )
СН4> CJHJ, NH3 ,
HCHO, KNO3 , H2 O
Винная кислота, KNO3> H2 Ö
CH3 COOHNH4 ,HjO (NH^COj
(NH3 CHj)2 CO3
Пропионовая кислота,
NH3 , H2 O
CH4 , NH3 , H2 O (SiO2 )
HCN, NH3 , H2 O, глицин, оксид алюминия
((CH3 )3 NH)2 CO3
Электрический
разряд То же
» п
УФ-облучение
УФ-облучение и электрический разряд Солнечный свет
Солнечный свет
(500 ч) /З-Излучение у-Излучение л, у-Излучение
Электрофорез в тлеющем разряде, 3 ч Тепловая энер-
л, у-Излучение
Gly, Ala, 0-А1а, Abu
Cys, цистин, Met и др. Gly, Ala, Nva, Abu,
Ser, Asp и др.
Ser, Asp, Asn, Gly, Ala, Thr, Val, Orn, Arg, Pro, Glu, Lys, Leu, He, His
Gly, Ala, Asp, Val, Lys
Phe, Туг и др.
Asp, Lys, Ala, Gly,
Orn, Arg, Glu, His, Ser,
Ala, /S-Ala, Gly
Gly, Ala, Ser, Asp, Thr, Glu, Val, Leu, Pro, He, alle Туг, Abu
Arg, Ala, Gly, Ser, Asp, Glu, Leu, lie, Abu, Thr
Gly, Ala, Lys, Val, Abu
ты - глицин, аланин, серии, аспарагиновая кислота - в количестве 0,1 мг/кг . Это свидетельствует о том, что на поверхности пепла при повышенных температурах может происходить синтез аминокислот из вулканических газов: СО, NH3 , CH4 .
1.5.4.10. Биосинтез аминокислот
Лишь 10 аминокислот могут синтезироваться в организмах млекопитающих. В синтезе этих заменимых аминокислот (рис. 1-11) используются простые продукты углеводного обмена; процесс включает несколько стадий.
NAD* NADH *UH,
:-сн2 -сн2 -сн-
HjN-CO-CHi-CHj-CH-COOH
у-полуальдегид глутаминовой кислоты
а-кетомаспяная кислота
H-C-NHa
H C O C - C - C H J - C H J - S - C H J - C - C O O H
цистатионин
о-кетоглутаровая
4-гомоцистеин
N*. N »-метилен-
3-фосфогидроксили ро-
3-фосфосерин
СерИН | (тятрягч^рп- 4
I ГЛИЦИН I
виноградная кислота
фолиевая кислота)
Рис. 1-11. Биосинтез заменимых аминокислот. Не показан синтез тирозина; он образуется гидроксилированием фенилаланина.
Аминокислоты
, органические кислоты, содержащие одну или несколько аминогрупп. В зависимости от природы кислотной функции аминокислоты
подразделяют на аминокарбоновые, например H 2 N(CH 2) 5 COOH, аминосульфоновые, например H 2 N(CH 2) 2 SO 3 H, аминофосфоновые, например H 2 NCH[Р(О)(ОН) 2 ] 2 , и аминоарсиновые, например H 2 NC 6 H 4 AsO 3 H 2 . Согласно правилам , название аминокислоты
производят от названия соответствующей кислоты; взаимное расположение в углеродной цепи карбоксильной и аминной групп обозначают обычно цифрами, в некоторых случаях - греческими буквами. Однако, как правило, пользуются тривиальными названиями аминокислоты
.
Структура и физические свойств аминокислот
По физическим и ряду химических свойств аминокислоты резко отличаются от соответствующих кислот и оснований (см. табл. 1 и 2). Они лучше растворимы в , чем в органических растворителях; хорошо кристаллизуются; имеют высокую плотность и исключительно высокие температуры (часто разложения). Эти свойства указывают на взаимодействие аминных и кислотных групп, вследствие чего аминокислоты в твердом состоянии и в растворе (в широком интервале рН) находятся в цвиттер-ионной форме. Например, для кислотно-основное равновесие:
Взаимное влияние групп особенно ярко проявляется у α-аминокислот, где обе группы находятся в непосредственной близости, а также у о-
и п
-аминобензойных кислот, где их взаимодействие передается через систему сопряженных связей. Благодаря электроноакцепторным свойствам группы
-N + Н 3 резко усиливается кислотность карбоксильных групп, например рК а
2,34, тогда как уксусной кислоты 4,75, β 3,6. Аминогруппа подвергается взаимокомпенсируемому влиянию электроноакцепторной карбонильной группы и электронодонорного отрицательно заряженного атома кислорода, в результате чего, например, основность аминогрупп аминоуксусной и п
-аминобензойной кислот мало отличается от основности соответственно и . Аминогруппа аминокислоты
ионизирована в несколько меньшей степени, чем карбоксильная группа, и водный раствор аминокислоты
имеет слабокислый характер. Значение рН, при котором аминокислоты
равна концентрации называется изоэлектрической точкой (рI
). Все аминокислоты
в изоэлектрической точке имеют минимум растворимости (в растворах кислот и растворимость возрастает). Вблизи рI
растворы аминокислоты
обладают минимальным буферным действием, а вблизи рК
каждой функциональной группы-максимальным.
Табл. 1 .- Свойства L-α-аминокислот
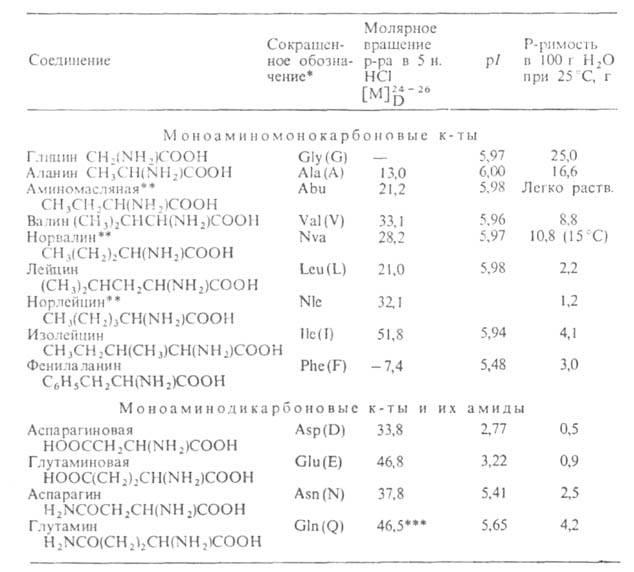
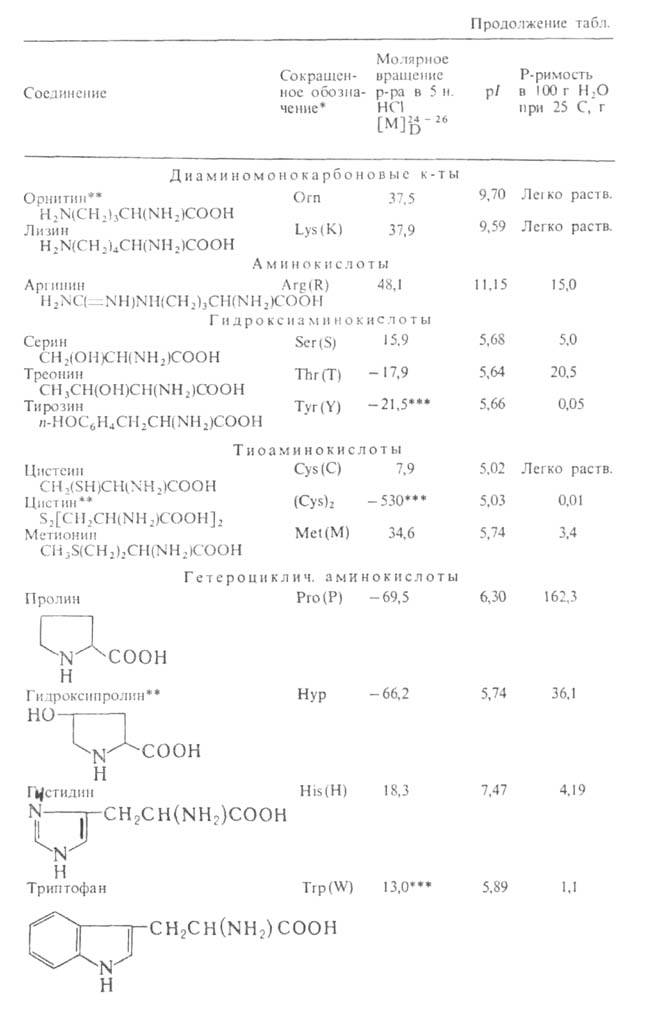
* В скобках дается однобукв. обозначение аминокислоты , рекомендуемое . ** Некодируемые аминокислоты к.: остальные кодируются генетич. кодом. *** Р-р в 1 н. НС1.
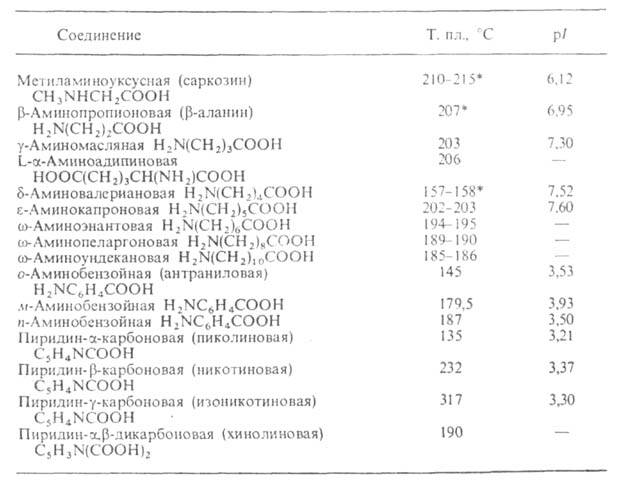
Табл. 2-СВОЙСТВА АМИНОКИСЛОТ
![]()
Цвиттер-ионная структура аминокислот
подтверждается их большим (не менее 50*10 -30 Кл*м), а также полосой поглощения 1610-1550 см -1 в ИК-спектре твердой аминокислоты
или ее раствора.
Все &alpha-аминокислоты, кроме аминоуксусной (глицина), имеют асимметричный α-углеродный атом и существуют в виде двух . За редким исключением природные &alpha-аминокислоты относятся к L-ряду (S-конфигурация).
При переходе от нейтральных растворов к кислым для аминокислот
L-ряда увеличивается положительное вращение, для D-ряда - отрицательное. Гидроксипролин, имеют два асимметричных и образуют по две . Оптическая активность аминокислоты
сильно зависит от длины волны поляризованного света (дисперсия оптического вращения). Как правило, аминокислоты
более устойчивы к , чем их производные. Повышенной конфигурационной стабильностью отличаются N-бензилоксикарбонильные производные аминокислот
.
аминокислоты
на оптические антиподы производят затравочной кристаллизацией их с арилсулъфокислотами или диастереомерных солей ацильных производных аминокислоты
с оптически активными основаниями или эфиров аминокислоты
с оптически активными кислотами. Часто используют энантиоселективный гидролиз ацилазами или эфиров аминокислоты
эстеразами, причем атакуют в первую очередь L-аминокислоты. Перспективно расщепление рацематов лигандообменной хроматографией. используют также для анализа энантиомерного состава аминокислоты
Химические свойства аминокислот
Реакции по карбоксильным группам аминокислот
, аминогруппа которых защищена или солеобразованием, протекают аналогично
превращениям карбоновых кислот. Аминокислоты
легко образуют соли, . амиды, гидразиды, азиды, галогенангидриды, смешанные ангидриды и т.д. Эфиры аминокислот
под действием или магнийорганических соединений превращаются в . При сухой в присутствии Ва(ОН) 2 аминокислоты
декарбоксилируются.
Реакции аминогрупп аминокислот
аналогичны превращениям аминов. Аминокислоты
образуют соли с минеральными кислотами и пикриновой кислотой, легко ацилируются хлорангидридами кислот в водно-щелочном растворе (реакция Шоттена-Баумана) и алкилируются алкилгалогенидами. Метилиодид и диазометан превращают аминокислоты
в (CH 3) 3 N + CHRCOO - . С аминокислоты
дают мегилольные или метиленовые производные, а в присутствии муравьиной кислоты или каталитически активированного Н 2 - N,N-диметиламинокислоты. Под действием HNO 2 ароматические аминогруппы диазотируются, а алифатические замещаются на . При обработке эфиров аминокислоты
и образуются производные и . При нагревании с или при одновременном воздействии и СО 2 аминокислоты
дают соли или эфиры N-карбоксипроизводных аминокислот
, а при использовании CS 2 -аналогичные дитиокарбаматы.
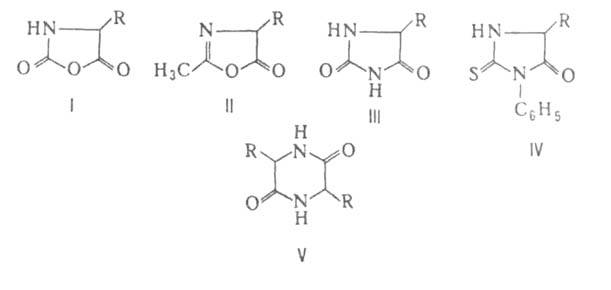
Реакции с одновременным участием групп NH 2 и СООН наиболее характерны для α-аминокислот, которые способны образовывать устойчивые 5-членные гетероциклы. С переходных металлов (Си, Zn, Ni, Co, Pb, Ag, Hg, Cr) α-аминокислоты образуют прочные хелатные комплексы, что используется в и в на основе аминокарбоновых и аминофосфоновых кислот. При взаимодейсвтии с α-аминокислоты превращаются в циклические ангидриды N-карбоксиаминокислот (ф-ла I), а при нагревании с уксусным ангидридом или - в азлактоны (II); нагревание аминокислоты с мочевиной или обработка дает гидантоины (III), а при использовании α-аминокислот, и особенно легко их эфиры, при нагревании превращаются в 2,5-пиперазиндионы, или дикетопиперазины (V). β-аминокислоты при нагревании дезаминируются и образуют α,β-ненасыщенные кислоты, γ- и δ-аминокислоты отщепляют воду и образуют 5- и 6-членные лактамы. при нагревании образует в основном и лишь частично превращается в капролактам, что характерно и для аминокислот с большим числом метиленовых звеньев между функциональными группами. Бетаины α-аминокислот при нагревании могут обратимо превращаться в эфиры диметиламинокислот, например:
При элиминировании бетаины β-аминокислот превращаются в ненасыщенные кислоты, γ- и δ-бетаины - в циклич. . При α-аминокислоты образуют с укороченной углеродной цепочкой. Из-за положительного заряда на четвертичном атоме N не образуют со щелочами. По аналогичной причине аминосульфоновые и аминофосфоновые кислоты не образуют солей с кислотами.
Анализ аминокислот
Обычно анализ α-аминокислот основан на взаимодействии с нингидрином, в результате которого аминокислота
расщепляется до альдегида, СО 2 и NH 3 , a NH 3 образует с нингидрином фиолетовый краситель. Для количественного определения измеряют объем выделившегося СО 2 или, чаще, фотометрируют образующийся краситель. Последний метод используется в автоматических хроматографах, позволяющих разделять на сульфокатионитах и количественно анализировать сложные смеси аминокислот и пептидов. Еще более чувствителен продуктов реакции аминокислоты
с о
-фталевым диальдегидом. Быстро развивается лигандообменный хроматографический анализ аминокислоты
и на силикагельных сорбентах в присутствии ионов . Бумажная и чаще используются для качественного анализа. Измерение объема N 2 , выделяющегося при дезаминировании аминокислоты
азотистой кислотой, а также титрование аминокислоты
щелочью в избытке формалина (методы Ван-Слайка и Сёренсена) сохранили лишь историческое значение.
Получение аминокислот
α-аминокислоты получают галогенированием карбоновых кислот или эфиров в α-положение с последующей заменой галогена на аминогруппу при обработке амином, аммиаком или фталимидом калия (по Габриелю).
По Штреккеру-Зелинскому α-аминокислоты получают из альдегидов:
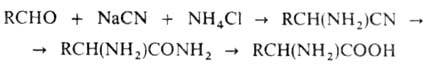
Этот метод позволяет также получать нитрилы и амиды соответствующих
В этой реакции вместо альдегидов могут быть использованы кетоны, а вместо диалкилфосфитов - диалкилтиофосфиты, кислые эфиры алкил(арил)фосфонистых кислот RP(OH)OR и диарилфосфиноксиды Аr 2 НРО. Таким путем получен широкий набор комплексонов.
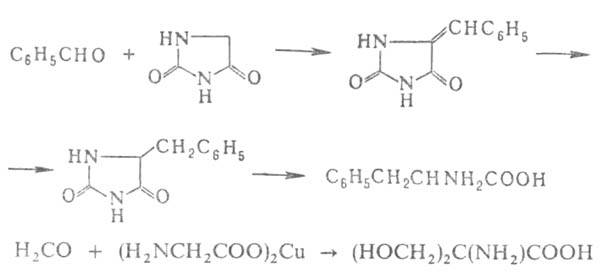
Альдегиды и кетоны или их более активные производные - кетзли - служат исходными соединениями для синтеза α-аминокислот с увеличением числа углеродных атомов на две единицы. Для этого их конденсируют с циклическими производными аминоуксусной кислоты - азалакгонами, гидантоинами, тиогидантоинами, 2,5-пиперазиндионами или с ее медными или кобальтовыми хелатами, например:
Удобные предшественники α-аминокислоты - аминомалоновый эфир и нитроуксусный эфир. К их α-углеродным атомам можно предварительно ввести желаемые радикалы методами алкилирования или конденсации. α-кетокислоты превращаются в α-аминокислоты гидрированием в присутствии NH 3 или гидрированием их оксимов или гидразонов.
Некоторые L-α-аминокислоты ввиду сложности синтеза и разделения оптических изомеров получают микробиологическим способом (лизин , триптофан, ) или выделяют из гидролизатов природных белковых продуктов (пролин, цистин, аргинин, гистидин). Перспективны смешанные химически-ферментативные способы синтеза, например:
α-Аминосульфоновые кислоты получают при обработке аммиаком продуктов присоединения NaHSO 3 к альдегидам:
β-аминокислоты синтезируют присоединением NH 3 или
(синоним аминокарбоновые кислоты ) - органические (карбоновые) кислоты, содержащие одну или более аминогрупп; основная структурная часть молекулы белков.
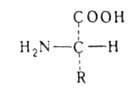
В зависимости от положения аминогруппы в углеродной цепи по отношению к карбоксильной группе (то есть у второго, третьего и так далее углеродных атомов) различают α-, β-, γ-аминокислоты и так далее. Многие Аминокислоты обнаружены в живых организмах в свободном виде или в составе более сложных соединений. Описано ок. 200 различных природных Аминокислоты, среди которых особенно важны около 20, входящих в состав белков (см.). Все найденные в белках Аминокислоты представляют собой α-аминокислоты и отвечают общей формуле: RCH(NH 2)COOH, где R - неодинаковый в разных аминокислот радикал, присоединенный ко второму углеродному атому цепи. К этому же углеродному атому присоединена и аминогруппа. Таким образом, у этого атома углерода 4 неодинаковых заместителя, и он является асимметрическим.
Еще до открытия Аминокислот как особого класса химических веществ французские химики Воклен и Робике (L. W. Vauquelin, P. J. Robiquet, 1806) изолировали из сока спаржи кристаллический аспарагин, представляющий собой амид аспарагиновой кислоты (см.) и входящий в качестве одной из аминокислот в состав белков.
Первая природная аминокислота (цистин) была открыта в 1810 году в мочевых камнях Волластоном (W. Н. Wollaston); в 1819 году Пруст (J. L. Proust), производя опыты по ферментации сыра, выделил кристаллы лейцина. В 1820 году Браконно (Н. Braconnot) получил из гидролизата желатины глицин, который имел сладкий вкус и был назван клеевым сахаром; лишь впоследствии глицин был отнесен к аминокислотам. Открытие Браконно сыграло особенно важную роль, поскольку оно явилось первым случаем получения Аминокислот из гидролизата белка; в дальнейшем из гидролизатов белков были выделены и идентифицированы и остальные аминокислоты, содержащиеся в составе белковых молекул.
Аминокислоты обладают рядом общих свойств: это бесцветные, кристаллические вещества, плавящиеся обычно с разложением при сравнительно высоких температурах, сладкие, горьковатые или пресные на вкус. Аминокислоты являются амфотерными электролитами, то есть образуют соли как с кислотами, так и с основаниями и обладают некоторыми свойствами, характерными и для органических кислот и для аминов. Природные α-аминокислоты могут вращать плоскость поляризации в разной степени вправо или влево в зависимости от природы аминокислот и условий среды, но все они принадлежат к L-ряду, то есть имеют одинаковую конфигурацию α-углеродного атома и могут рассматриваться как производные L-аланина или, соответственно, L-глицерпнового альдегида. Разнообразие свойств и характера радикалов различных Аминокислот определяет многообразие и специфические свойства как отдельных аминокислот, так и белковых молекул, в состав которых они входят. Химическое строение и важнейшие свойства природных аминокилот, встречающихся в гпдролизатах белков, приведены в табл. 1.
| Название | Рациональное название | Формула | Молекулярный вес | Температура плавления | Растворимость в граммах на 100 г воды при t° 25° |
|---|---|---|---|---|---|
| α-Аминопропионовая кислота | 89,09 | 297° (с разложением) | 16,51 | ||
| α-Амино-δ-гуанидинвалериановая кислота |
| 174,20 | 238° (с разложением) | Легко растворим | |
| γ-Амид α-аминоянтарной кислоты |
| 132,12 | 236° (с разложением) | 3,11 (28°) | |
| α-Аминоянтарная кислота |
| 133,10 | 270° | 0,50 | |
| α-Аминоизовалериановая (α-амино-β-метилмасляная) кислота |
| 117,15 | 315° (с разложением) | 8,85 | |
| α-Амино-β-имидазолилпропионовая кислота |
| 155,16 | 277° (с разложением) | 4,29 | |
| Глицин (гликокол) | Аминоуксусная кислота |
| 75,07 | 290° (с разложением) | 24,99 |
| δ-Амид-α-аминоглутаровой кислоты |
| 146,15 | 185° | 3,6 (18°) | |
| α-Аминоглутаровая кислота |
| 147,13 | 249° | 0,843 | |
| α-Амино-β-метилвалериановая кислота |
| 131,17 | 284° (с разложением) | 4,117 | |
| α-Аминоизокапроновая кислота |
| 131,17 | 295° (с разложением) | 2,19 | |
| α-, ε-Диаминокапроновая кислота |
| 146,19 | 224° (с разложением) | Легко растворим | |
| α-Амино-γ-метилтиомасляная кислота |
| 149,21 | 283° (с разложением) | 3,35 | |
| γ-Оксипирролидин- α-карбоновая кислота |
| 131,13 | 270° | 36,11 | |
| Пирролидин-α-карбоновая кислота |
| 115,13 | 222° | 162,3 | |
| α-Амино-β-оксипропионовая кислота |
| 105,09 | 228° (с разложением) | 5,023 | |
| α-Амино-β-параоксифенилпропионовая кислота |
| 181,19 | 344° (с разложением) | 0,045 | |
| α-Амино-β-оксимасляная кислота |
| 119,12 | 253° (с разложением) | 20,5 | |
| α-Амино-β-индолилпр опионовая кислота |
| 204,22 | 282° (с разложением) | 1,14 | |
| α-Амино-β-фенилпропионовая кислота |
| 165,19 | 284° | 2,985 | |
| α-Амино-β-тиопропионовая кислота |
| 121,15 | 178° | - | |
| Ди-α-амино-β-тиопропионовая кислота |
| 240,29 | 261° (с разложением) | 0,011 |
Электрохимические свойства
Обладая амфотерными свойствами (см. Амфолиты), аминокислоты в растворах диссоциируют как по типу кислотной диссоциации (отдавая ион водорода и заряжаясь при этом отрицательно), так и по типу щелочной диссоциации (присоединяя Н-ион и освобождая ион гидроксила), приобретая при этом положительный заряд. В кислой среде усиливается щелочная диссоциация аминокилот и происходит образование солей с анионами кислот. В щелочной среде, наоборот, аминокислоты ведут себя как анионы, образуя соли с основаниями. Установлено, что Аминокислоты в растворах практически полностью диссоциируют и находятся в виде амфотерных (биполярных) ионов, называемых также цвиттерионами или амфиионами:
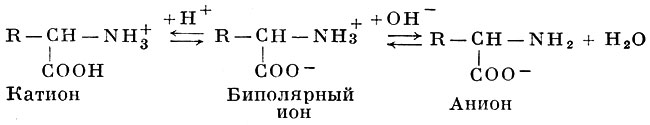
В кислой среде амфотерный ион присоединяет ион водорода, подавляющий кислотную диссоциацию, и превращается в катион; в щелочной среде с присоединением иона гидроксила подавляется щелочная диссоциация, и биполярный ион становится анионом. При определенном значении рН среды, неодинаковом для разных аминокислот, степень кислотной и щелочной диссоциации для данной аминокилоты уравнивается, и в электрическом поле аминокислот не движется ни к катоду, ни к аноду. Это значение рН называют изоэлектрической точкой (pI), которая тем ниже, чем больше у данной аминокилоты выражены кислотные свойства, и тем выше, чем у аминокислоты больше выражены основные свойства (см. Изоэлектрическая точка). При рI растворимость аминокислоты становится минимальной, в соответствии с чем ее легче осадить из раствора.
Оптические свойства
Все α-аминокислоты, за исключением глицина (см.), имеют асимметрический атом углерода. Таким атомом всегда является 2-й, или α-углеродный, атом, все четыре валентности которого заняты различными группами. В этом случае возможны две стереоизомерные формы, являющиеся зеркальным отражением друг друга и несовместимые между собой подобно правой и левой руке. На схеме изображены два стереоизомера аминокислоты аланина в виде объемного изображения и соответствующей ему проекции на плоскости. Изображение слева условно принято считать левой конфигурацией (L), справа - правой конфигурацией (D). Такие конфигурации соответствуют лево- и правовращающему глицериновому альдегиду, который принят за исходное соединение при определении конфигурации молекул. Показано, что все природные аминокислоты, получаемые из гидролизатов белков, по конфигурации α-углеродного атома соответствуют L-ряду, то есть могут рассматриваться как производные L-аланина, в котором один водородный атом в метальной группе заменен на более сложный радикал. Удельное вращение плоскости поляризации света отдельных Аминокислот зависит как от свойств всей молекулы в целом, так и рН-раствора, температуры и других факторов.
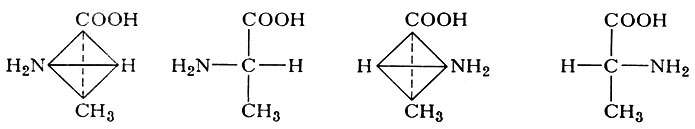
Удельное вращение важнейших аминокислот, их изоэлектрические точки и показатели констант кислотной диссоциации (рК а) представлены в табл. 2.
| Аминокислота | Удельное вращение | Константы кислотной диссоциации | Изоэлектрическая точка рI | |||
|---|---|---|---|---|---|---|
| водного раствора | в 5 н. растворе соляной кислоты | pK 1 | pK 2 | pK 3 | ||
| Алании | +1,6 | +13,0 | 2,34 | 9,69 | 6,0 | |
| Аргинин | +21,8 | +48,1 | 2,18 | 9,09 | 13,2 | 10,9 |
| Аспарагин | -7,4 | +37,8 | 2,02 | 8,80 | 5,4 | |
| Аспарагиновая кислота | +6,7 | +33,8 | 1,88 | 3,65 | 9,60 | 2,8 |
| Валии | +6,6 | 33,1 | 2,32 | 9,62 | 6,0 | |
| Гистидин | +59,8 | +18,3 | 1,78 | 5,97 | 8,97 | 7,6 |
| 2,34 | 9,60 | 6,0 | ||||
| Глутамин | +9,2 | +46,5 | 2,17 | 9,13 | 5,7 | |
| Глутаминовая кислота | +17,7 | +46,8 | 2,19 | 4,25 | 9,67 | 3,2 |
| Изолейцин | +16,3 | +51,8 | 2,26 | 9,62 | 5,9 | |
| Лейцин | -14,4 | +21,0 | 2,36 | 9,60 | 6,0 | |
| Лизин | +19,7 | +37,9 | 2,20 | 8,90 | 10,28 | 9,7 |
| Метионин | -14,9 | +34,6 | 2,28 | 9,21 | 5,7 | |
| Оксипролин | -99,6 | -66,2 | 1,82 | 9,65 | 5,8 | |
| Пролин | -99,2 | -69,5 | 1,99 | 10,60 | 6,3 | |
| Серии | -7,9 | +15,9 | 2,21 | 9,15 | 5,7 | |
| Тирозин | -6,6 | -18,1 | 2,20 | 9,11 | 10,07 | 5,7 |
| Треонин | -33,9 | -17,9 | 2,15 | 9,12 | 5,6 | |
| Триптофан | -68,8 | +5,7 | 2,38 | 9,39 | 5,9 | |
| Фенилаланин | -57,0 | -7,4 | 1,83 | 9,13 | 5,5 | |
| Цистеин | -20,0 | +7,9 | 1,71 | 8,33 | 10,78 | 5,0 |
| Цистин | 2,01 | 8,02 pK 4 = 8,71 | 5,0 | |||
Раньше оптические антиподы L-аминокислот, то есть аминокислоты D-ряда, называли «неприродными», однако в наст, время аминокислоты D-ряда обнаружены в составе некоторых бактериальных продуктов и антибиотиков. Так, капсулы спороносных бактерий (Вас. subtilis, В. anthracis и другое) в значительной мере состоят из полипептида, построенного из остатков D-глутаминовой кислоты. D-аланин и D-глутамидовая кислота входят в состав мукопептидов, образующих клеточные стенки ряда бактерий; валин, фенилаланин, орнитин и лейцин D-ряда содержатся в составе грамицидинов и многих других пептидов - антибиотиков и тому подобное Стереоизомерные аминокислоты существенно различаются по своим биологическим свойствам, они атакуются ферментами, специфическими только к определенной оптической конфигурации, не заменяют или лишь частично заменяют друг друга в обмене веществ и тому подобное D-изомеры (см.), лейцина (см.), серина (см.), триптофана (см.) и валина (см.) очень сладкие, тогда как L-стереоизомеры аланина и серина умеренно сладкие, триптофана - безвкусны, а лейцина и валина - горьковаты. Характерный «мясной» вкус L-глутаминовой к-ты отсутствует у D-формы. Синтетические аминокислоты обычно представляют собой рацематы, то есть смесь равных количеств D- и L-форм. Их обозначают как DL-аминокислоты. При помощи некоторых специальных реактивов или обработки некоторыми ферментами синтетические аминокислоты можно разделить на D- и L-формы или получить только один желаемый стереоизомер.
Классификация аминокислот
Характерные свойства отдельных Аминокислот определяются боковой цепью, то есть радикалом, стоящим у α-углеродного атома. В зависимости от строения этого радикала аминокислоты подразделяют на алифатические (к ним относится большинство аминокислот), ароматические (фенилаланин и тирозин), гетероциклические (гистидин и триптофан) и иминокислоты (см.), у которых атом азота, стоящий при α-углеродном атоме, соединен с боковой цепью в пирролидиновое кольцо; к ним относятся пролин и оксипролин (см. Пролин).
По числу карбоксильных и аминных групп аминокислоты делят следующим образом.
Моноаминомонокарбоновые аминокислоты содержат одну карбоксильную и одну аминную группы; к ним относится большая часть аминокислот (их рI лежит ок. рН 6).
Моноаминодикарбоновые аминокислоты содержат две карбоксильные и одну аминную группы. Аспарагиновая и глутаминовая кислота (см.) обладают слабокислыми свойствами.
Диаминомонокарбоновые кислоты - аргинин (см.), лизин (см.), гистидин (см.) и орнитин - в водном растворе диссоциируют преимущественно как основания.
По химическому составу замещающих групп различают: оксиаминокислоты (содержат спиртовую группу) - серин и треонин (см.), серосодержащие аминокислоты (содержат в своем составе атомы серы) - цистеин, цистин (см.) и метионин (см.); амиды (см.) дикарбоновых аминокислот - аспарагин (см.) и глутамин (см.) и тому подобное Аминокислоты с углеводородным радикалом, например аланин, лейцин, валин и другие, придают белкам гидрофобные свойства; если радикал содержит гидрофильные группы, как, например, у дикарбоновых аминокислот, они сообщают белку гидрофильность.
Помимо уже упомянутых аминокислот (см. таблицу и соответствующие статьи), в тканях человека, животных, растений и у микроорганизмов найдено еще более 100 аминокислот, многие из которых играют важную роль в живых организмах. Так, орнитин и цитруллин (относятся к диаминокарбоновым аминокислотам) играют важную роль в обмене веществ, в частности в синтезе мочевины у животных (см. Аргинин, Мочевина). В организмах найдены высшие аналоги глутаминовой кислоты: α-аминоадипиновая кислота с б атомами углерода и α-аминопимелиновая кислота с 7 атомами углерода. В составе коллагена и желатина найден оксилизин:
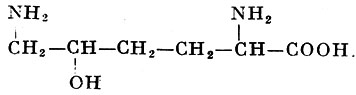
имеющий два асимметрических атома углерода. Из алифатических моноаминомонокарбоновых аминокислот встречаются α-аминомасляная кислота, норвалин (α-аминовалериановая кислота) и норлейцин (α-ампнокапроновая кислота). Последние две получены синтетически, но не встречаются в составе белков. Гомосерин (α-амино-γ-оксимасляная кислота) является высшим аналогом серина. Соответственно α-амино-γ-тиомасляная кислота, или гомоцистеин, является подобным аналогом цистеина. Две последние аминокислоты наряду с лантионином:
[НООС-CH(NH 2)-СН 2 -S-CH 2 -CH(NH 2)-COOH]
и цистатионином:
[НООС-CH(NH 2)-CH 2 -S-СН 2 -СН 2 -CH(NH 2)-COOH]
принимают участие в обмене серосодержащих аминокислот 2,4-Диоксифенилаланин (ДОФА) является промежуточным продуктом обмена фенилаланина (см.) и тирозина (см.). Из тирозина образуется такая аминокислота, как 3,5-дийодтирозин - промежуточный продукт образования тироксина (см.). В свободном состоянии и в составе некоторых природных веществ встречаются аминокислоты, метилированные (см. Метилирование) по азоту: метилглицин, или саркозин , а также метилгистидин, метилтриптофан, метиллизин. Последний недавно обнаружен в составе ядерных белков - гистонов (см.). Описаны также ацетилированные производные аминокислот, в том числе ацетиллизин составе гистонов.
Помимо α-аминокислот в природе, главным образом в свободном виде и в составе некоторых биологически важных пептидов, встречаются Аминокислот, содержащие аминогруппу у других атомов углерода. К ним относятся β-аланин (см. Аланин), γ-аминомасляная кислота (см. Аминомасляные кислоты), играющая важную роль в функционировании нервной системы, δ-аминолевулиновая кислота, являющаяся промежуточным продуктом синтеза порфиринов. К аминокислотам относят также таурин (H 2 N-CH 2 -CH 2 -SO 3 H), образующийся в организме в процессе обмена цистеина.
Получение аминокислот
Аминокислоты получают различными методами, некоторые из них предназначены специально для получения тех или иных аминокислот. Наиболее распространенными общими методами химического синтеза аминокислоты являются следующие.
1. Аминирование галоидопроизводных органических кислот. На галоидопроизводное (обычно бромзамещенную кислоту) действуют аммиаком, в результате чего галоид замещается на аминогруппу.
2. Получение аминокислоты из альдегидов путем обработки их аммиаком и цианистым водородом или цианидами. В результате такой обработки получается циангидрин, который далее аминируется, образуя аминонитрил; омыление последнего дает аминокислоту.
3. Конденсация альдегидов с производными глицина с последующим восстановлением и гидролизом.
Отдельные аминокислоты могут быть получены из гидролизатов белков в виде труднорастворимых солей или других производных. Например, цистин и тирозин легко осаждаются в изо электрической точке; диаминокислоты осаждают в виде солей фосфорно-вольфрамовой, пикриновой (лизин), флавпановой (аргинин) и других кислот; дикарбоновые аминокислоты осаждают в виде кальциевых или бариевых солей, глутаминовая кислота выделяется в виде аминокислот гидрохлорида в кислой среде, аспарагиновая кислота - в виде медной соли и так далее. Для препаративного выделения ряда аминокислот из гидролизатов белка применяют также методы хроматографии и электрофореза. Для промышленных целей многие аминокислоты получают методами микробиологического синтеза, выделяя их из культуральной среды определенных штаммов бактерий.
Определение аминокислот
В качестве общей реакции на аминокислоты чаще всего применяют цветную реакцию с нингидрипом (см.), который при нагревании дает с разными аминокислотами фиолетовое окрашивание различных оттенков. Применяют также реактив Фолина (1,2-нафтохинон-4-сульфоиово-кислый натрий), дезаминирование азотистой кислотой с газометрическим определением выделяющегося азота по Ван-Слайку (см. Ван-Слайка методы).
Определение отдельных аминокислот, а также аминокислотного состава белков и свободных аминокислот крови и других жидкостей и тканей организма обычно производят методами хроматографии на бумаге или на ионообменных смолах (см. Хроматография) или электрофореза (см.). Эти методы позволяют качественно и количественно определять малые количества (доли миллиграмма) любых аминокислот с применением эталонных образцов этих соединений в качестве «свидетелей» или стандартов. Обычно пользуются автоматическими анализаторами аминокислот (см. Автоанализаторы), проводящими за несколько часов полный аминокислотный анализ образцов, содержащих всего несколько миллиграммов аминокислоты. Еще более быстрым и чувствительным методом определения аминокислоты является газовая хроматография их летучих производных.
Аминокислоты, поступающие в организм человека и животных с пищей, главным образом в виде пищевого белка, занимают центральное место в азотистом обмене (см.) и обеспечивают синтез в организме его собственных белков и нуклеиновых кислот, ферментов, многих коферментов, гормонов и других биологически важных веществ; в растениях из аминокислот образуются алкалоиды (см.).
В крови человека и животных в норме поддерживается постоянный уровень содержания аминокислот в свободном виде и в составе небольших пептидов. В плазме крови человека в среднем содержится 5-6 мг азота аминокислот (обычно называемого аминоазотом) на 100 мл плазмы (см. Азот остаточный). В эритроцитах содержание аминоазота в 11/2-2 раза выше, в клетках органов и тканей оно еще выше. В сутки с мочой выделяется около 1 г аминокислот(табл. 3). При обильном и несбалансированном белковом питании, при нарушении функции почек, печени и других органов, а также при некоторых отравлениях и наследственных нарушениях обмена аминокислот содержание их в крови повышается (гипераминоацидемия) и с мочой выделяются заметные количества аминокислот. (см. Аминоацидурия).
| Аминокислота | Плазма крови (мг %) | Моча за 24 часа (мг ) |
|---|---|---|
| Азот аминокислот | 5,8 | 50-75 |
| Алании | 3,4 | 21-71 |
| Аргинин | 1,62 | - |
| Аспарагиновая кислота | 0,03 | |
| Валин | 2,88 | 4-6 |
| Гистидин | 1,38 | 113-320 |
| 1,5 | 68-199 | |
| Глутаминовая кислота | 0,70 | 8-40 |
| Изолейцин | 1,34 | 14-28 |
| Лейцин | 1,86 | 9-26 |
| Лизин | 2,72 | 7-48 |
| Метионин | 0,52 | |
| Орнитин | 0,72 | - |
| Пролив | 2,36 | |
| Серии | 1,12 | 27-73 |
| Тирозин | 1,04 | 15-49 |
| Треонин | 1,67 | 15-53 |
| Триптофан | 1,27 | - |
| Цистин (+цистеин) | 1,47 | 10-21 |
Активный транспорт аминокислот
Существенную роль в обмене аминокислоты играет активный транспорт аминокислоты против градиента концентрации. Этот механизм поддерживает концентрацию аминокислоты в клетках на более высоком уровне, чем их концентрация в крови, а также регулирует всасывание аминокислоты из кишечника (в процессе переваривания белковой пищи) и обратное всасывание их из почечных канальцев после фильтрации мочи в мальпигиевых клубочках. Активный транспорт аминокислоты связан с действием специфических белковых факторов (пермеаз и транслоказ), избирательно связывающих аминокислоты и осуществляющих их активный перенос за счет распада богатых энергией соединений. Взаимная конкуренция одних аминокислот между собой за активный перенос и отсутствие ее у других аминокислот показывает, что существует несколько систем активного транспорта аминокислоты - для отдельных групп аминокислот. Так, цистин, аргинин, лизин и орнитин обладают общей системой транспорта и конкурируют между собой в этом процессе. Другая система транспорта обеспечивает перенос через мембраны глицина, пролина и оксипролина и, наконец, третья система, по-видимому, является общей для большой группы остальных аминокислот.
Роль аминокислот в питании
Человек и животные используют в обмене веществ азот, поступающий с пищей в виде аминокислоты, главным образом в составе белков, некоторых других органических соединений азота, а также аммонийные соли. Из этого азота путем процессов аминирования и трансаминирования (см. Переаминирование) в организме образуются различные аминокислоты. Некоторые аминокислоты не могут синтезироваться в животном организме, и для поддержания жизни эти аминокислоты должны обязательно поступать в организм с пищей. Такие аминокислоты называют незаменимыми. Незаменимые аминокислоты для человека: триптофан (см.), фенилаланин (см.), лизин (см.), треонин (см.), валин (см.), лейцин (см.), метионин (см.) и изолейцин (см.). Остальные аминокислоты относят к заменимым, но некоторые из них заменимы лишь условно. Так, тирозин образуется в организме только из фенилалашгаа и при поступлении последнего в недостаточном количестве может оказаться незаменимым. Подобно этому цистеин и цистин могут образоваться из метионина, но необходимы при недостатке этой аминокислоты. Аргинин синтезируется в организме, но скорость его синтеза может оказаться недостаточной при повышенной потребности (особенно при активном росте молодого организма). Потребность в незаменимых аминокислот изучалась в исследованиях по азотистому равновесию, белковому голоданию, учету потребляемой пищи и другое. Тем не менее потребность в них не поддается точному учету и может быть оценена лишь приблизительно. В табл. 4 приведены данные о рекомендуемых и безусловно достаточных для человека количествах незаменимых аминокислот. Потребность в незаменимых аминокислот возрастает в периоды интенсивного роста организма, при повышенном распаде белков при некоторых заболеваниях.
Принадлежность аминокислоты к заменимым или незаменимым для различных организмов не совсем одинакова. Так, например, аргинин и гистидин, относящиеся к заменимым аминокислотам для человека, незаменимы для кур, а гистидин также для крыс и мышей. Аутотрофные организмы (см.), к которым относятся растения и многие бактерии, способны синтезировать все необходимые аминокислоты. Однако ряд бактерий нуждается в наличии тех или иных аминокислот в культуральной среде. Известны виды или штаммы бактерий, избирательно нуждающиеся в наличии определенных аминокислот. Такие мутантные штаммы, рост которых обеспечивается только при добавлении в среду определенной кислоты, называют ауксотрофными (см. Ауксотрофные микроорганизмы). Ауксотрофные штаммы растут на среде, полноценной в остальных отношениях, со скоростью, пропорциональной количеству добавленной незаменимой аминокислоты, поэтому их иногда применяют для микробиологического определения содержания данной аминокислоты в тех или иных биологических материалах, например Гатри метод (см.).
Недостаток в питании одной из незаменимых аминокислот приводит к нарушению роста и общей дистрофии, но отсутствие некоторых аминокислот может давать также специфические симптомы. Так, недостаток триптофана нередко дает иеллагроподобные явления, поскольку из триптофана в организме образуется никотиновая кислота (у экспериментальных крыс при недостатке триптофана наблюдается помутнение роговицы, катаракта, выпадение шерсти, анемия); недостаток метионина приводит к поражению печени и почек; недостаток валина вызывает неврологические симптомы и так далее.
Полноценное питание обеспечивается при сбалансированном содержании отдельных аминокислот в пище. Избыток некоторых аминокислот также неблагоприятен. Избыток триптофана приводит к накоплению продукта его обмена - 3-оксиантраниловой кислоты, которая может вызывать опухоли мочевого пузыря. При несбалансированном питании избыток некоторых аминокислот может нарушать обмен или использование других аминокислот и вызывать недостаточность последних.
Патология обмена аминокислот
Наиболее частой причиной амнноацидурий и гипераминоацидемий являются заболевания почек, связанные с нарушением выделения и обратного всасывания аминокислоты. Ряд специфических нарушений обмена аминокислоты связан с наследственной недостаточностью определенных ферментов, участвующих в их метаболизме.
Так, редкое, но давно известное заболевание - алкаптонурия обусловлено недостаточностью в организме фермента - оксидазы гомогентизиновой кислоты (одного из продуктов промежуточного обмена тирозина). При алкаптонурии гомогентпзи новая кислота выделяется с мочой и, окисляясь на воздухе, окрашивает ее в черный цвет. Хотя алкаптонурия обнаруживается с младенчества, клинические нарушения при этом незначительны и сводятся лишь к большей подверженности особому виду артропатии (охронозу). Другим наследственным нарушением обмена аминокислоты является фенилкетонурия. При этом заболевании имеет место недостаточность или отсутствие фермента фенилаланин-4-гидроксилазы, вследствие чего нарушается превращение фенилаланина в тирозин; тирозин, в норме не являющийся незаменимой аминокислоты, у больных фенилкетонурией становится незаменимым, поскольку он не может образовываться из фенилаланина. Фенилкетонурия связана с тяжелыми клиническими нарушениями, из которых наиболее важным является нарушение развития головного мозга и вследствие этого тяжелая умственная отсталость, проявляющаяся с раннего детства. Причиной этих нарушений является избыточное накопление фенилаланина в крови (гиперфенилаланинемия) и в моче, в особенности накопление продуктов его обмена, в частности фенилпировиноградной кислоты (фенилкетонурия), от которой и происходит название этой болезни. В наст, время развитие неврологических нарушений, вызванных фенилкетонурией, успешно смягчают, назначая младенцам специальную диету с очень низким содержанием фенилаланина. Некоторые важнейшие наследственные нарушения обмена аминокислот представлены в табл. 5.
| Название | Фермент, недостаточность которого вызывает нарушение обмена | Причина нарушения обмена | Некоторые патологические проявления |
|---|---|---|---|
| Тирозинемия | Оксидаза п-оксифенилпировиноградной кислоты | Неспособность превращать п-оксифенилпировиноградную кислоту в гомогентизиновую кислоту | Тяжелое поражение печени и почечных канальцев, нередко смертельное в младенчестве |
| Гистидинемия | Гистидаза (гистидин-α-дезаминаза) | Неспособность образовывать урокининовую кислоту из гистидина. Повышенное содержание в крови и выделение с мочой гистидина и имидазолпировиноградной кислоты | Дефекты речи. Нередко некоторая степень умственной отсталости |
| Гомоцистинурия | Цистатионин-синтетаза (сериндегидратаза) | Неспособность образовывать цистатионин из гомоцистеина и серина. Повышенное содержание гомоцистина и метионина в сыворотке и аномальное выделение гомоцистина с мочой | Умственная отсталость, аномалии развития скелета, эктопия хрусталика, артериальная и венозная тромбоэмболия |
| Цистатионинурия | Цистатионаза (гомосериндегидратаза) | амНеспособность расщеплять цистатионин с образованием цистина, α-кетобутирата и аммиака. Значительное выделение цистатионина с мочой и повышенное содержание его в тканях и сыворотке | Иногда умственная отсталость и психические нарушения |
| Лейциноз (болезнь «кленового сиропа») | Декарбоксилаза (декарбоксилазы) кетокислот с разветвленной углеродной цепью | Нарушение декарбоксилирования кетокислот (α-кето-изовалериановой, α-кето-β-метилвалериановой и α-кетоизокапроновой), являющихся продуктами дезаминирования аминокислоты валина, изолейцина и лейцина, и выделение этих кетокислот и соответствующих аминокислот с мочой | Характерный запах мочи, напоминающий кленовый сироп. Прогрессирующее неврологическое заболевание с выраженной дегенерацией мозга, обычно начинающееся вскоре после рождения и кончающееся летально в течение нескольких недель или месяцев. В более легки» случаях перемежающиеся приступы токсической энцефалопатии и выделения названных кетокислот и аминокислоты с мочой |
| Один из типов кретинизма с зобом | Йодотирозиндейодиназа | Нарушение дейодирования моно- и дийодтирозина при синтезе тиреоидного гормона | Резкое увеличение щитовидной железы, сопровождающееся тяжелым гипотиреоидизмом |
| Гипервалинемия | Валинтрансаминаза | Нарушение переаминирования валина; повышенное содержание его в крови и выделение с мочой | Нарушение развития и умственная отсталость |
| Изовалериановая ацидемия | Изовалерил-кофермент А-дегидрогеназа | Повышенные количества изовалериановой кислоты (продукта дезаминирования валина) в крови и моче | Периодические приступы ацидоза и комы |
| Гиперпролинемия | Пролиноксидаза | Повышенное содержание в сыворотке и выделение с мочой пролина вследствие нарушения превращения его в Δ 1 -пирролидин-5-карбоксилат | В некоторых случаях нарушение функции почек и умственная отсталость |
| Оксипролинемия | Оксипролиноксидаза | Нарушение превращения оксипролина в Δ 1 -пирролидин-3-окси-5-карбоксилат и повышенное содержание оксипролина в сыворотке и моче | Тяжелая умственная отсталость |
Особое место занимают резко выраженные аминоацидурии (см.), возникающие в результате нарушения транспорта аминокислоты и, соответственно, всасывания их из почечных канальцев и из кишечника. К таким нарушениям относится цистинурия, диагностированная по выделению с мочой цистина и отложению его в виде камней и осадков в мочевых путях. В действительности цистинурия связана с нарушением общей системы активного транспорта четырех аминокислот - лизина, аргинина, орнитина и цистина. При цистинурии выделяется в среднем более 4 г этих аминокислоты в сутки, из которых только около 0,75 г приходится на долю цистина, однако именно цистин вследствие своей низкой растворимости выпадает при этом в осадок и вызывает отложение камней. Нарушение другой системы активного транспорта, общей для глицина, пролина и оксипролина, приводит к повышенному выделению с мочой этих трех аминокислот (без появления признаков клинических нарушений). Наконец, нарушение еще одной общей системы транспорта аминокислоты, к которым относится, по-видимому, большая группа всех остальных аминокислот, называемое болезнью Хартнупа, связано с многообразными клиническими проявлениями, неодинаковыми в разных случаях заболевания.
Применение аминокислот
Аминокислоты находят широкое применение в медицине и других областях. Различные наборы аминокислоты и гидролизаты белков, обогащенные отдельными аминокислотами, применяются для парентерального питания при операциях, заболеваниях кишечника и нарушениях всасывания. Некоторые аминокислоты оказывают специфический терапевтический эффект при различных расстройствах. Так, метионин применяют при ожирении печени, циррозах и тому подобное; глутаминовая и γ-амино-масляная кислоты дают хороший эффект при некоторых заболеваниях центральной нервной системы (эпилепсии, реактивных состояниях и так далее); гистидин иногда применяют для лечения больных гепатитами, язвенной болезнью желудка и двенадцатиперстной кишки.
Аминокислоты применяют также в качестве добавок к пищевым продуктам. Практически наиболее важны добавки лизина, триптофана и метионина к пищевым продуктам, неполноценным по содержанию этих аминокислот. Добавка глутаминовой к-ты и ее солей к ряду продуктов придает им приятный мясной вкус, что часто используют в кулинарии. Помимо питания человека и применения аминокислоты в пищевой промышленности, их используют для кормления животных, для приготовления культуральных сред в микробиологической промышленности и как реактивы.
Гистохимические методы выявления аминокислот в тканях
Реакции выявления аминокислоты в тканях основаны главным образом на выявлении аминогрупп (NH 2 -), карбоксильных (СООН-), сульфгидрильных (SH-) и дисульфидных (SS-) групп. Разработаны методы выявления отдельных аминокислот (тирозина, триптофана, гистидина, аргинина). Идентификация аминокислоты проводится также при помощи блокирования тех или иных групп. Следует иметь в виду, что гистохимик имеет дело, как правило, с денатурированным белком, поэтому результаты гистохимических методов не всегда сопоставимы с биохимическими.
Для выявления SH- и SS-групп лучшей считается реакция с 2,2′-диокси - 6,6′ - динафтилдисульфидом (ДДД), основанная на образовании нафтил дисульфид а, связанного с белком, содержащим SH-группы. Для развития окраски препарат обрабатывают солью диазония (прочный синий Б или прочный черный К), которая соединяется с нафтилдисульфидом, образуя азокраситель, окрашивающий участки локализации SH-и SS-групп в тканях в оттенки от розового до сине-фиолетового. Метод позволяет проводить количественные сопоставления. Ткань фиксируется в жидкости Карнуа, Буэна, в формалине. Лучшие результаты дает 24-часовая фиксация в 1% растворе трихлоруксусной кислоты на 80% спирте с последующей промывкой в серии спиртов возрастающей концентрации (80, 90, 96%), затем производится обезвоживание и заливка в парафин. Для реакции необходимы реактивы: ДДД, соль диазония, 0,1 М веронал-ацетатный буферный раствор (рН 8,5), 0,1 М фосфатный буферный раствор (рН 7,4), этиловый спирт, серный эфир.
α-Аминокислоты выявляются с помощью нингидрин-реактива Шиффа. Метод основан на взаимодействии нингидрина с аминогруппами (NH 2 -); образующийся при этом альдегид выявляется реактивом Шиффа. Материал фиксируется в формалине, безводном спирте, жидкости Ценкера, заключается в парафин. Необходимы реактивы: нингидрин, реактив Шиффа, этиловый спирт. Ткани, содержащие α-аминогруппы, окрашиваются в розовато-малиновые оттенки. Специфичность реакции, однако, является спорной, так к окислению нингидрином могут подвергаться не только α-аминокислоты, но и другие алифатические амины.
Тирозин, триптофан, гистидин выявляются тетразониевым методом. Соли диазония в щелочной среде находятся в виде гидроксидов диазония, присоединяющихся к названным аминокислотам. Для усиления цветной окраски срезы обрабатывают β-нафтолом или Н-кислотой. Фиксация формалином, жидкостью Карнуа. Необходимые реактивы: тетразотированный бензидин или лучше прочный синий Б, 0,1 М вероналацетатный буферный раствор (рН 9,2); 0,1 н. HCl, Н-кислота или β-нафтол. В зависимости от реактива срезы окрашиваются в фиолетово-синий или коричневый цвет. При оценке результатов нужно иметь в виду возможность присоединения к гидроксиду диазония фенола и ароматических аминов. Для дифферен-цировки аминокислот применяют контрольные реакции.
Из Дополнительных материалов
При написании последовательности аминокислотных остатков в полипептидной цепи Международный союз теоретической и прикладной химии и Международный биохимический союз предложили пользоваться сокращенными названиями аминокислоты, состоящими обычно из первых трех букв полного названия соответствующей аминокислоты (см. таблицу). Использование интернациональной латинизированной стандартной системы символов и сокращений представляет большие преимущества с точки зрения сбора, обработки и отыскания научной информации, устранения ошибок при переводе текстов с иностранных языков и тому подобное. Унифицированные сокращенные названия химических соединений, в том числе и аминокислот, особенно важны не только в международном отношении, но и для применения внутри СССР, где научная литература издается на десятках языков, различных по алфавиту, лексике и начертанию специальных терминов и их сокращенных обозначений.
Сокращенные обозначения свободных аминокислот не следует употреблять в тексте работ, это допустимо только в таблицах, списках, схемах.
Там, где последовательность аминокислотных остатков в пептидной цепи известна, символы остатков пишут по порядку, соединяя их дефисами; та цепь или часть цепи, где последовательность соединения аминокислотных остатков неизвестна, заключается в круглые скобки, причем символы остатков аминокислоты разделяются запятыми. При написании линейных пептидов или белков на левом конце установленной последовательности (то есть на ее N-конце) ставится символ аминокислоты, несущей свободную аминогруппу, а на правом конце (на C-конце) - символ остатка аминокислоты, несущего свободную карбоксильную группу. Полипептидную цепь предпочтительнее изображать горизонтально, а не вертикально расположенной последовательностью. Символы аминокислоты обозначают природные (L-) формы, их антиподы - символом D-, который ставят непосредственно перед символом аминокислоты, не отделяя от него дефисом (например, Лей-DФен-Гли).
Символы менее распространенных в живой природе аминокислоты особо оговариваются в каждой публикации. Рекомендуется соблюдать лишь следующие принципы, например, гидроксиаминокислоты (оксиаминокислоты): гидроксилизин (оксилизин) - Hyl (Оли) и так далее; алло-аминокислоты: алло-изо лейцин - aile (аИле), алло-оксилизин - aHyl (аОли); нораминокислоты: норвалин -Nva (Нва), норлейцин - Nle (Нле) и т. д.
Таблица. Сокращенное написание символов аминокислот, наиболее распространенных в живой природе
|
Полное название аминокислоты |
Международные символы |
Символы, принятые в русских научных изданиях |
|
Аспарагин |
||
|
Аспарагиновая кислота |
||
|
Аспарагиновая кислота и л pi аспарагин (если различие не установлено) |
||
|
Гидроксипролин |
||
|
Гистидин |
||
|
Глутамин |
||
|
Глутаминовая кислота |
||
|
Глутаминовая кислота или глутамин (если различие не установлено) |
||
|
Изолейцин |
||
|
Метионин |
||
|
Триптофан |
||
|
Фенилаланин |
||
Библиография
Браунштейн А. Е. Биохимия аминокислотного обмена, М., 1949, библиогр.; Майстер А. Биохимия аминокислот, пер. с англ., М., 1961; Greenstein J. P. a. Winitz M. Chemistry of the amino acids, v. 1-3, N. Y.-L., 1961; Meister A. Biochemistry of the amino acids, v. 1-2, N. Y., 1965; Nivard R. J. Е. а. Тesser G. I. Amino acids and related compounds, Comprehens. Biochem., v. 6, p. 143, 1965, bibliogr.; Номенклатура биологической химии, пер. с англ., под ред. А. Е. Браунштейна, в. 1, с. 13 и др., М., 1968.
Гистохимические методы выявления Аминокислот в тканях
Лилли Р. Патогистологическая техника и практическая гистохимия, пер. с англ., М., 1969, библиогр.; Пирс Э. Гистохимия, пер. с англ., с. 73, М., 1962; Принципы и методы гистоцитохимического анализа и патологии, под ред. А. П. Авцына и др., Л., 1971, библиогр.
И. Б. Збарский; Р. А. Симакова (гист.), Н. Г. Будковская.
По характеру углеводородных заместителей амины делят на
Общие особенности строения аминов
Также как и в молекуле аммиака, в молекуле любого амина атом азота имеет неподеленную электронную пару, направленную в одну из вершин искаженного тетраэдра:
По этой причине у аминов как и у аммиака существенно выражены основные свойства.
Так, амины аналогично аммиаку обратимо реагируют с водой, образуя слабые основания:
Связь катиона водорода с атомом азота в молекуле амина реализуется с помощью донорно-акцепторного механизма за счет неподеленной электронной пары атома азота. Предельные амины являются более сильными основаниями по сравнению с аммиаком, т.к. в таких аминах углеводородные заместители обладают положительным индуктивным (+I) эффектом. В связи с этим на атоме азота увеличивается электронная плотность, что облегчает его взаимодействие с катионом Н + .
Ароматические амины, в случае если аминогруппа непосредственно соединена с ароматическим ядром, проявляют более слабые основные свойства по сравнению с аммиаком. Связано это с тем, что неподеленная электронная пара атома азота смещается в сторону ароматической π-системы бензольного кольца в следствие чего, электронная плотность на атоме азота снижается. В свою очередь это приводит к снижению основных свойств, в частности способности взаимодействовать с водой. Так, например, анилин реагирует только с сильными кислотами, а с водой практически не реагирует.
Химические свойства предельных аминов
Как уже было сказано, амины обратимо реагируют с водой:
Водные растворы аминов имеют щелочную реакцию среды, вследствие диссоциации образующихся оснований:
Предельные амины реагируют с водой лучше, чем аммиак, ввиду более сильных основных свойств.
Основные свойства предельных аминов увеличиваются в ряду.
Вторичные предельные амины являются более сильными основаниями, чем первичные предельные, которые являются в свою очередь более сильными основаниями, чем аммиак. Что касается основных свойств третичных аминов, то то если речь идет о реакциях в водных растворах, то основные свойства третичных аминов выражены намного хуже, чем у вторичных аминов, и даже чуть хуже чем у первичных. Связано это со стерическими затруднениями, существенно влияющими на скорость протонирования амина. Другими словами три заместителя «загораживают» атом азота и мешают его взаимодействию с катионами H + .
Взаимодействие с кислотами
Как свободные предельные амины, так и их водные растворы вступают во взаимодействие с кислотами. При этом образуются соли:
Так как основные свойства предельных аминов сильнее выражены, чем у аммиака, такие амины реагируют даже со слабыми кислотами, например угольной:
Соли аминов представляют собой твердые вещества, хорошо растворимые в воде и плохо в неполярных органических растворителях. Взаимодействие солей аминов с щелочами приводит к высвобождению свободных аминов, аналогично тому как происходит вытеснение аммиака при действии щелочей на соли аммония:
2. Первичные предельные амины реагируют с азотистой кислотой с образованием соответствующих спиртов, азота N 2 и воды. Например:
Характерным признаком данной реакции является образование газообразного азота, в связи с чем она является качественной на первичные амины и используется для их различения от вторичных и третичных. Следует отметить, что чаще всего данную реакцию проводят, смешивая амин не с раствором самой азотистой кислоты, а с раствором соли азотистой кислоты (нитрита) и последующим добавлением к этой смеси сильной минеральной кислоты. При взаимодействии нитритов с сильными минеральными кислотами образуется азотистая кислота, которая уже затем реагирует с амином:
Вторичные амины дают в аналогичных условиях маслянистые жидкости, так называемые N-нитрозаминами, но данная реакция в реальных заданиях ЕГЭ по химии не встречается. Третичные амины с азотистой кислотой не взаимодействуют.
Полное сгорание любых аминов приводит к образованию углекислого газа, воды и азота:
Взаимодействие с галогеналканами
Примечательно, что абсолютно такая же соль получается при действии хлороводорода на более замещенный амин. В нашем случае, при взаимодействии хлороводорода с диметиламином:
Получение аминов:
1) Алкилирование аммиака галогеналканами:
В случае недостатка аммиака вместо амина получается его соль:
2) Восстановление металлами (до водорода в ряду активности) в кислой среде:
с последующей обработкой раствора щелочью для высвобождения свободного амина:
3) Реакция аммиака со спиртами при пропускании их смеси через нагретый оксид алюминия. В зависимости от пропорций спирт/амин образуются первичные, вторичные или третичные амины:
Химические свойства анилина
Анилин – тривиальное название аминобензола, имеющего формулу:
Как можно видеть из иллюстрации, в молекуле анилина аминогруппа непосредственно соединена с ароматическим кольцом. У таких аминов, как уже было сказано, основные свойства выражены намного слабее, чем у аммиака. Так, в частности, анилин практически не реагирует с водой и слабыми кислотами типа угольной.
Взаимодействие анилина с кислотами
Анилин реагирует с сильными и средней силы неорганическими кислотами. При этом образуются соли фениламмония:
Взаимодействие анилина с галогенами
Как уже было сказано в самом начале данной главы, аминогруппа в ароматических аминах, втянута в ароматическое кольцо, что в свою очередь снижает электронную плотность на атоме азота, и как следствие увеличивает ее в ароматическом ядре. Увеличение электронной плотности в ароматическом ядре приводит к тому, что реакции электрофильного замещения, в частности, реакции с галогенами протекают значительно легче, особенно в орто- и пара- положениях относительно аминогруппы. Так, анилин с легкостью вступает во взаимодействие с бромной водой, образуя белый осадок 2,4,6-триброманилина:
Данная реакция является качественной на анилин и часто позволяет определить его среди прочих органических соединений.
Взаимодействие анилина с азотистой кислотой
Анилин реагирует с азотистой кислотой, но в виду специфичности и сложности данной реакции в реальном ЕГЭ по химии она не встречается.
Реакции алкилирования анилина
С помощью последовательного алкилирования анилина по атому азота галогенпроизводными углеводородов можно получать вторичные и третичные амины:
Химические свойства аминокислот
Аминокислотами называют соединения в молекулах которых присутствуют два типа функциональных групп – амино (-NH 2) и карбокси- (-COOH) группы.
Другими словами, аминокислоты можно рассматривать как производные карбоновых кислот, в молекулах которых один или несколько атомов водорода замещены на аминогруппы.
Таким образом, общую формулу аминокислот можно записать как (NH 2) x R(COOH) y , где x и y чаще всего равны единице или двум.
Поскольку в молекулах аминокислот есть и аминогруппа и карбоксильная группа, они проявляют химические свойства схожие как аминов, так и карбоновых кислот.
Кислотные свойства аминокислот
Образование солей с щелочами и карбонатами щелочных металлов
Этерификация аминокислот
Аминокислоты могут вступать в реакцию этерификации со спиртами:
NH 2 CH 2 COOH + CH 3 OH → NH 2 CH 2 COOCH 3 + H 2 O
Основные свойства аминокислот
1. Oбразование солей при взаимодействии с кислотами
NH 2 CH 2 COOH + HCl → + Cl —
2. Взаимодействие с азотистой кислотой
NH 2 -CH 2 -COOH + HNO 2 → НО-CH 2 -COOH + N 2 + H 2 O
Примечание: взаимодействие с азотистой кислотой протекает так же, как и с первичными аминами
3. Алкилирование
NH 2 CH 2 COOH + CH 3 I → + I —
4. Взаимодействие аминокислот друг с другом
Аминокислоты могут реагировать друг с другом образуя пептиды – соединения, содержащие в своих молекулах пептидную связь –C(O)-NH-
При этом, следует отметить, что в случае проведения реакции между двумя разными аминокислотами, без соблюдения некоторых специфических условий синтеза, одновременно протекает образование разных дипептидов. Так, например, вместо реакции глицина с аланином выше, приводящей к глицилананину, может произойти реакция приводящая к аланилглицину:
Кроме того, молекула глицина не обязательно реагирует с молекулой аланина. Протекают также и реакции пептизации между молекулами глицина:
И аланина:
Помимо этого, поскольку молекулы образующихся пептидов как и исходные молекулы аминокислот содержат аминогруппы и карбоксильные группы, сами пептиды могут реагировать с аминокислотами и другими пептидами, благодаря образованию новых пептидных связей.
Отдельные аминокислоты используются для производства синтетических полипептидов или так называемых полиамидных волокон. Так, в частности с помощью поликонденсации 6-аминогексановой (ε-аминокапроновой) кислоты в промышленности синтезируют капрон:
Получаемая в результате этой реакции капроновая смола используется для производства текстильных волокон и пластмасс.
Образование внутренних солей аминокислот в водном растворе
В водных растворах аминокислоты существуют преимущественно в виде внутренних солей — биполярных ионов (цвиттер-ионов).