Газообразное вещество имеет форму и объем. Реальные и идеальные газы
А. увеличивается
Б. уменьшается
2. Молекулы различных веществ …
А. не отличаются друг от друга
Б. отличаются друг от друга
3. Из явления диффузии можно сделать вывод о том, что …
А. все тела состоят из мельчайших частиц
Б. молекулы всех веществ неподвижны
В. молекулы всех веществ непрерывно движутся
4. Процесс диффузии происходит …
А. только в жидкостях и газах
Б. только в жидкостях и твердых телах
В. в газах, жидкостях и твердых телах
5. Молекулы (атомы) притягиваются друг к другу.
При этом они должны как бы слипнуться.
Этого не происходит, потому что …
А. молекулы (атомы) непрерывно движутся
Б. между молекулами (атомами) существуют силы отталкивания
6. Какие из указанных свойств принадлежат жидкостям?
А. легко меняют свою форму, но сохраняют объем
Б. не имеют собственной формы и постоянного объема
В. имеют собственную форму и объем
7. Как расположены частицы в твердых телах?
А. Частицы расположены на расстояниях, много больших размеров частиц
Б. Частицы расположены в определенном (строгом) порядке
В. Частицы расположены близко друг к другу, но строгого порядка
в их расположении нет
8. В каком состоянии может находится чугун?
А. только в жидком
Б. только в твердом
В. в твердом, жидком и газообразном
9. В бутылке находится вода объемом 0,2 л.
Ее переливают в колбу вместимостью 0,5 л.
Изменится ли объем воды?
А. Уменьшится
Б. Не изменится
В. Увеличится
10. В помещениях, где пользуются медицинским эфиром, обычно сильно им пахнет.
В каком состоянии находится эфир в этом помещении?
А. в твердом
Б. в жидком
В. в газообразном
Характеристика газообразного состояния вещества
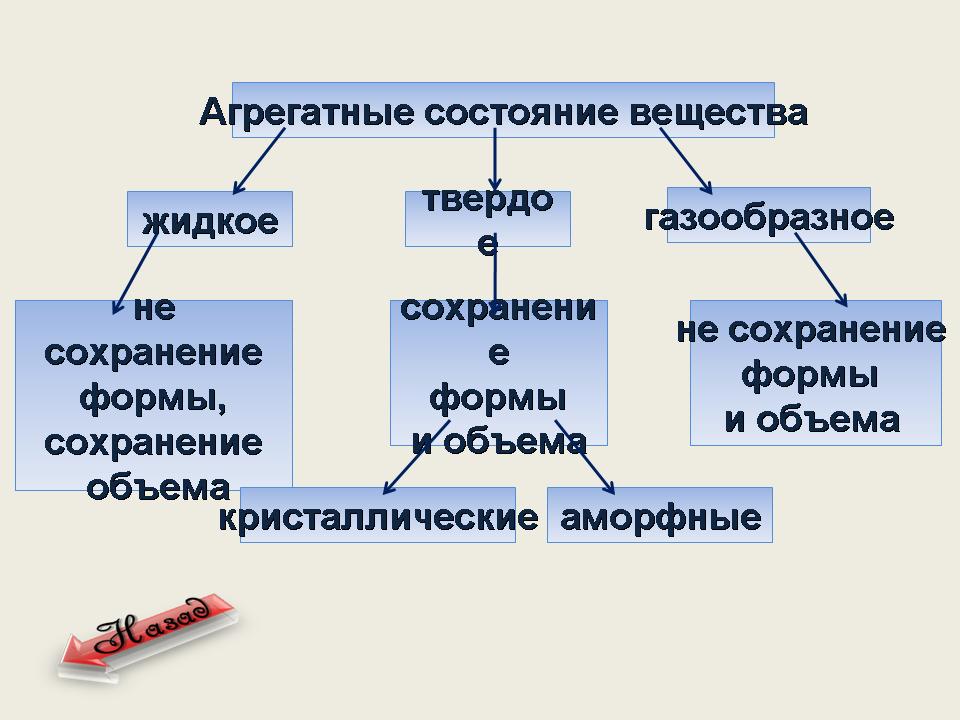
Агрегатные состояния веществ, их характеристика
В зависимости от внешних условий (температуры и давления) каждое вещество может находиться в одном из трех агрегатных состояний: твердом, жидком или газообразном .Эти состояния называются агрегатными состояниями .Для некоторых веществ характерно только два или даже одно агрегатное состояние. Например, нафталин, йод при нагревании в обычных условиях из твердого состояния переходят в газообразное, минуя жидкое. Такие вещества, как белки, крахмал, каучуки, имеющие огромные макромолекулы, не могут существовать в газообразном состоянии.
Газы не имеют постоянной формы и постоянного объема. Жидкости имеют постоянный объем, но не имеют постоянной формы. Твердые характеризуются постоянством формы и объема.
Характеристика газообразного состояния вещества
Для газов характеры следующие свойства:
Равномерное заполнение всего предоставленного объема;
Малая плотность по сравнению с жидкими и твердыми веществами и большая скорость диффузии;
Сравнительно легкая сжимаемость.
Эти свойства определяются силами межмолекулярного притяжения и расстоянием между молекулами.
В газе молекулы находятся на очень большом расстоянии друг от друга, силы притяжения между ними ничтожно малы. При низких давлениях расстояния между молекулами газа настолько велики, что по сравнению с ними размером молекул, а, следовательно, объемом молекул в общем объеме газа можно пренебречь. При больших расстояниях между молекулами практически отсутствуют силы притяжения между ними. Газ в таком состоянии называется идеальным .При нормальных условиях Т=273 0 К (0 0 С) и p=101,325 кПа реальные газы независимо от природы можно считать идеальными иприменять к ним уравнение состояния идеального газа (уравнение Клайперона-Менделеева):
PV = n RT, (2.1)
где Р– давление газа,
V – объем газа,
n – количество вещества,
R – универсальная газовая постоянная (в единицах СИ R =8,314 Дж/мольК),
Т – абсолютная температура.
Реальные газы при высоких давлениях и низких температурах не подчиняются уравнению состояния идеального газа, так как в этих условиях начинают проявляться силы взаимодействия между молекулами и уже нельзя пренебрегать собственным объемом молекул по сравнению с объемом тела. Для математического описания поведения реальных газов используют уравнение Ван-дер-Ваальса:
(р + n 2 a/V 2) (V – nb) = vRT, (2.2)
где а и b – постоянные,
a/V 2 – поправка на взаимное притяжение,
b – поправка на собственный объем молекул,
n– число молей газа.
С увеличением давления и понижением температуры расстояния между молекулами уменьшаются, а силы взаимодействия увеличиваются так, что вещество из газообразного состояния может перейти в жидкое. Для каждого газа существует предельная критическая температура , выше которой газ не может быть превращен в жидкость ни при каком давлении. Давление, необходимое для сжижения газа при критической температуре, называется критическим давлением ,а объем одного моля газа при этих условиях критическим объемом .
Рис. 1. Изотермы реального газа
Состояние газа при критических параметрах называют критическим состоянием .В критическом состоянии исчезает различие между жидкостью и газом, они имеют одинаковые физические свойства.
Переход газа в жидкость можно показать графически. На рисунке 1 приведена графическая зависимость между объемом и давлением при постоянных температурах. Такие кривые называются изотермами. У изотерм можно выделить три участка: АВ, ВС, CD при низких температурах. АВ – соответствует газообразному состоянию, ВС – отвечает переходу газа в жидкость, CD – характеризует жидкое состояние. С повышением температуры участок ВС уменьшается и превращается в точку перегиба К, называемую критической точкой.
Газ — это состояние вещества, в котором оно не имеет соб-ственной формы и заполняет весь предоставленный ему объем; его молекулы находят-ся в постоянном хаотическом движении и взаимодействуют лишь при столкновениях меж-ду собой и стенками сосуда, в котором они находятся.
По молекулярным представлениям, газы состоят из атомов или молекул, расстояние между которыми значительно превышает их размеры. Именно поэтому силы взаимодей-ствия между молекулами газов практически отсутствуют, а следовательно, молекулы га-зов не удерживаются друг возле друга, а постоянно хаотически перемещаются. Вза-имодействие между ними фактически про-исходит лишь при кратковременных столк-новениях.
При обычных условиях собственный объем молекул газа значительно меньше объема сосуда, в котором он находится. В связи с этим газы легко сжимаются. Они не имеют собственной формы и заполняют весь объем сосуда, в котором находятся.
Большинство уравнений и законов спра-ведливы для идеального газа — упрощенной модели реальных газов. Прежде всего, это ка-сается взаимодействия между молекулами — оно должно быть настолько малым, что им можно пренебречь. При таких условиях учи-тывается лишь кинетическая энергия мо-лекул, поскольку потенциальная энергия их взаимодействия практически равна нулю.
Следующее ограничение касается разме-ра молекул. Поскольку взаимодействие моле-кул идеального газа сводится лишь к кратковременным столкновениям, то размер мо-лекул не влияет на давление и температуру газа. Поэтому молекулы идеального газа можно считать материальными точками.
Идеальный газ — это модель газа, которая предусматривает пренебрежение раз-мерами молекул и их взаимодействием; мо-лекулы такого газа находятся в свободном беспорядочном движении, иногда сталкива-ясь с другими молекулами или стенками сосуда, в котором они находятся. Материал с сайта
Реальные газы приобретают такие свойст-ва при значительном разрежении, когда сред-нее расстояние между молекулами намного больше их размера. При таких условиях практически отсутствуют силы притяжения, а силы отталкивания действуют лишь при кратковременных столкновениях молекул между собой.
Молекулярно-кинетическая тео-рия накладывает ряд ограни-чений на реальный газ , бла-годаря которым его можно счи-тать идеальным . Это газ, раз-мерами и взаимодействием мо-лекул которого можно пренеб-речь.
На этой странице материал по темам:
Объясните, почему газ не имеет собственной формы и собственного объема
Объясните почему газы не имеют собственной формы и постоянного объема
Почему газ не имеет форму и объм
Реальные газы конспект
Почему газы не имеют собственной формы и объема
Вопросы по этому материалу:
![]()










 Назад
Вперёд
Назад
Вперёд
Внимание! Предварительный просмотр слайдов используется исключительно в ознакомительных целях и может не давать представления о всех возможностях презентации. Если вас заинтересовала данная работа, пожалуйста, загрузите полную версию.
Цели урока:
Образовательная – сформировать представления о некоторых механических свойствах твердых тел, жидкостей, газов.
Развивающая – развивать речевые и мыслительные навыки учащихся, умения анализировать, умения делать выводы по изученному материалу.
Воспитательная – способствовать воспитанию ответственности, стремление к успеху, создать условия повышения интереса к изучаемому предмету.
Оборудование: компьютер, мультимедиа проектор.
Ход урока
I. Оргмомент.
II. Актуализация знаний.
Все любят отгадывать кроссворды. Мы с вами тоже отгадаем кроссворд, но физический (слайд 1).
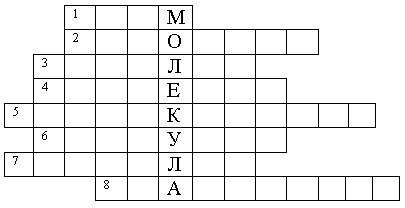
По горизонтали:
1. Мельчайшая “неделимая” частица. (Атом)
2. Древнегреческий учёный, который ввёл понятие атома. (Демокрит)
3. Процесс консервирования овощей и рыбы, при котором используется явление диффузии. (Засолка)
4. Диффузия доказывает … молекул. (Движение)
5. Один из видов взаимодействия молекул. (Отталкивание)
6. Явление самопроизвольного перемешивания вещества. (Диффузия)
7. Тонкие трубки, по которым поднимается или опускается жидкость из-за взаимодействия молекул. (Капилляр)
8. Явление, доказывающее взаимодействие молекул. (Смачивание)
III. Мотивация.
Нас окружают различные тела. Тела состоят из различных веществ.
Какое вещество вы видите на слайде 2? (Ответ: Вода)
Когда вода замерзает образуется… (лед). (слайд 3)
Лед, какое это состояние воды? (Твердое)
Здесь одновременно существует два различных состояния воды – жидкое и твердое. В атмосфере вода содержится в невидимом глазу состоянии – пар. Когда пара становится много, в атмосфере образуются облака. (Cлайд 4)
В каких состояниях может находиться вода? (Твердое, жидкое, газообразное)
Эти состояния вещества называются агрегатными. Это и будет темой сегодняшнего урока “Агрегатные состояния вещества”. (Cлайд 5, 6) (Дальнейшую демонстрацию можно сопровождать музыкой, которая записана в презентации).
IV. Усвоение новых знаний. (Дальнейший переход к слайдам осуществляется по ссылке на слайде 6)
В различных состояниях вещества обладают разными свойствами. Большинство окружающих нас тел состоят из твёрдых веществ. Это дома, машины, инструменты и т.д.
Назовите ещё примеры твёрдых тел.
Форму твёрдого тела можно изменить, но для этого необходимо приложить усилие. Например, чтобы согнуть гвоздь, нужно приложить довольно большое усилие.
Для придания твёрдым телам нужной формы и объёма на заводах и фабриках их обрабатывают специальными станками.
Какое общее свойство объединяет их?
(Твёрдое тело имеет собственную форму и объём). (Cлайд 7)
Второе состояние вещества - жидкое. (Cлайд 8). В отличие от твёрдых тел жидкости легко меняют свою форму. Они принимают форму сосуда в котором находятся.
Например, молоко, наполняющее бутылку, имеет форму бутылки. Налитое же в стакан оно принимает форму стакана. Но, изменяя форму, жидкость сохраняет свой объём.
В обычных условиях только маленькие капельки жидкости имеют свою форму - форму шара. Это, например, капли дождя, или капли, на которые разбивается струя жидкости.
На свойстве жидкости легко изменять свою форму основано изготовление предметов из расплавленного стекла.
Давайте сделаем вывод: Жидкости легко меняют свою форму, но сохраняют объём. (Cлайд 9)
Воздух, которым мы дышим, является газообразным веществом, или газом. Поскольку большинство газов бесцветны и прозрачны, то они невидимы.
Присутствие воздуха можно почувствовать, стоя у открытого окна движущегося поезда. Его наличие в окружающем пространстве можно ощутить, если в комнате возникает сквозняк, а также доказать с помощью простых опытов. (Cлайд 10).
Можно ли заполнить газом сосуд наполовину его объема? Почему?
Вывод: Вещество в газообразном состоянии не имеет собственной формы и объёма.
V. Работа с учебником. Учащиеся читают абзац, выделяют нужную информацию и отвечают на вопросы (слайд 12). Далее совместно с учителем подводят итог. (Cлайд 11, 13)
Газы. Расстояние между молекулами во много раз больше самих молекул, они почти не притягиваются и свободно движутся. Поэтому газы заполняют весь предоставленный объём, не имеют формы и легко сжимаются. Но если газы сильно сжать или охладить они переходят в жидкое состояние.
Жидкости. Молекулы расположены близко друг к другу, расстояние между ними сравнимо с размером молекул. Они скачками меняют свое место – “прыгают”. Поэтому жидкости не сохраняют форму, они могут течь, их легко перелить. Но сжать их трудно, так как при этом молекулы сближаются и между ними возникает отталкивание.
Твердые тела. Молекулы расположены в строгом порядке расстояние между молекулами сравнимо с размером молекул. Молекулы колеблются около определенной точки, не могут перемещаться далеко от неё. Поэтому твердые тела сохраняют форму и объем. Кристаллические тела.
VI. Самостоятельная работа.
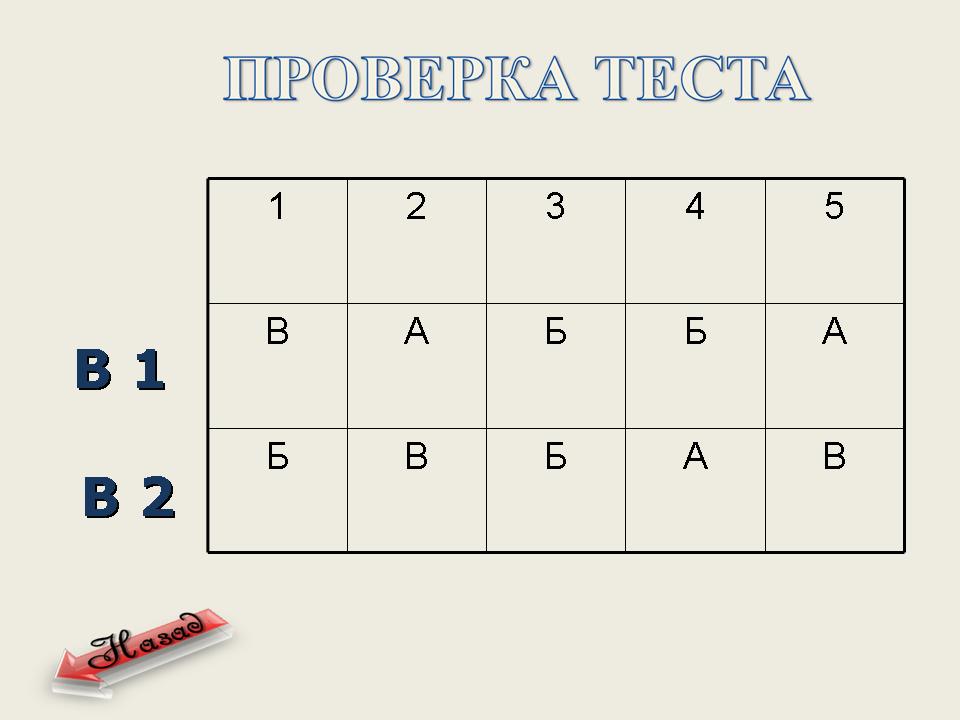
Учащиеся выполняют краткий тест по вариантам. Проверка теста. (Слайд 14)
Тест
Вариант 1
1. Какие из указанных свойств принадлежат газам?
А. Имеют собственную форму.
Б. Сохраняют объём.
2. Как расположены молекулы газа?
В. Расположены в определенном порядке.
3. В каком состоянии может находиться ртуть?
А. Только в жидком.
В. Только в твердом.
4. Можно ли открытый сосуд заполнить газом на 40% его вместимости?
А. Да, можно.
Б. Нет, нельзя.
В. Определенного ответа нет.
5. Вода замерзла и превратилась в лед. Изменились ли при этом сами молекулы воды?
А. Нет, не изменились.
Б. Да, изменились.
В. Определенного ответа нет.
Вариант 2
1. Какие из указанных свойств принадлежат жидкостям?
А. Имеют собственную форму и объем.
Б. Легко меняют форму, но сохраняют объем.
В. Не имеют собственной формы и постоянного объёма.
2. Как расположены молекулы в твердых телах?
А. Двигаясь беспорядочно во всех направлениях, почти не притягиваются друг к другу.
Б. Не расходятся на большие расстояния.
В. Расположены в определенном (строгом) порядке.
3. В каком состоянии может находиться чугун?
А. Только в жидком.
Б. В жидком, твердом, газообразном.
В. Только в твердом.
4. В бутылке находится вода объемом 0,2 л. Её переливают в колбу вместимостью 0,5 литра. Изменится ли объем воды?
А. Не изменится.
Б. Увеличится.
В. Уменьшится.
5. В помещениях, где пользуются медицинским эфиром, обычно сильно им пахнет. В каком состоянии находится эфир в помещении?
А. Только в жидком.
Б. В жидком, твердом, газообразном.
В. Только в газообразном.
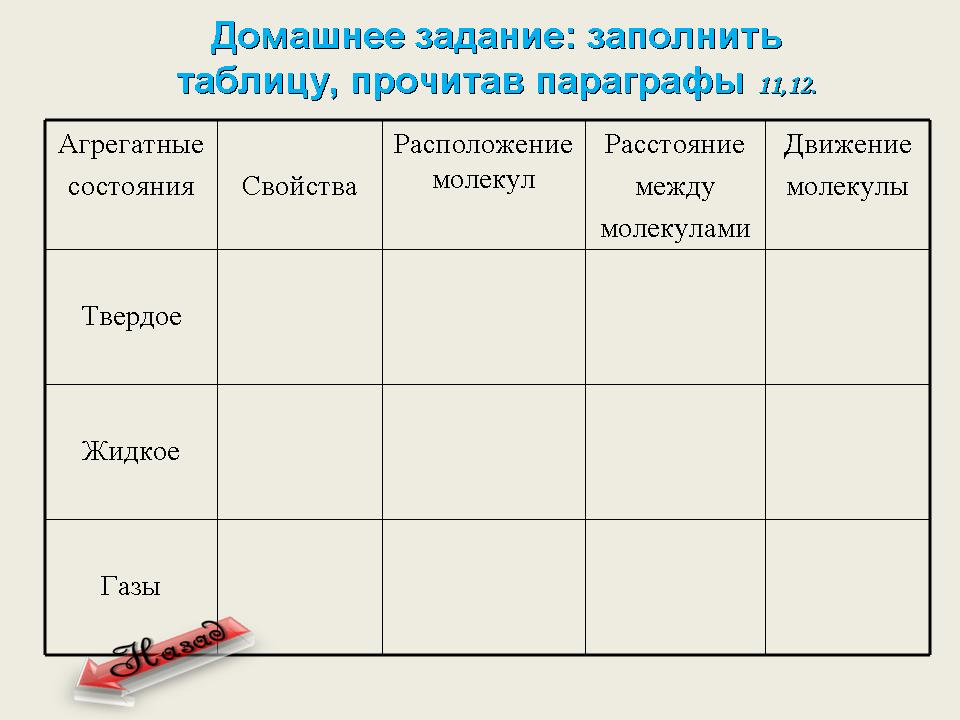
VII. Домашнее задание. Обобщение знаний: заполнить таблицу. (Слайд 15)
VIII. Итог урока.
Учитель отмечает наиболее активных учеников, выставляет оценки.
Любое вещество состоит из молекул, а его физические свойства зависят от того, каким образом упорядочены молекулы и как они взаимодействуют между собой. В обычной жизни мы наблюдаем три агрегатных состояния вещества - твердое, жидкое и газообразное. Например, вода может находиться в твердом (лед), жидком (вода) и газообразном (пар) состояниях. В градуснике ртуть - это жидкость. Над поверхностью ртути находятся ее пары, а при температуре -39°С ртуть превращается в твердое тело.
Газ Газ расширяется, пока не заполнит весь отведенный ему объем. Если рассмотреть газ на молекулярном уровне, мы увидим беспорядочно мечущиеся и сталкивающиеся между собой и со стенками сосуда молекулы, которые, однако, практически не вступают во взаимодействие друг с другом. Если увеличить или уменьшить объем сосуда, молекулы равномерно перераспределятся в новом объеме.
![]()
Жидкость
В отличие от газа
при заданной температуре занимает фиксированный объем, однако и она принимает форму заполняемого сосуда - но только ниже уровня ее поверхности. На молекулярном уровне жидкость проще всего представить в виде молекул-шариков, которые хотя и находятся в тесном контакте друг с другом, однако имеют свободу перекатываться друг относительно друга, подобно круглым бусинам в банке. Налейте жидкость в сосуд - и молекулы быстро растекутся и заполнят нижнюю часть объема сосуда, в результате жидкость примет его форму, но не распространится в полном объеме сосуда.
Твердое тело Твердое тело имеет собственную форму, не растекается по объему контейнера
 и не принимает его форму. На микроскопическом уровне атомы прикрепляются друг к другу химическими связями, и их положение друг относительно друга фиксировано. При этом они могут образовывать как жесткие упорядоченные структуры - кристаллические решетки, - так и беспорядочное нагромождение - аморфные тела (именно такова структура полимеров, которые похожи на перепутанные и слипшиеся макароны в миске).
и не принимает его форму. На микроскопическом уровне атомы прикрепляются друг к другу химическими связями, и их положение друг относительно друга фиксировано. При этом они могут образовывать как жесткие упорядоченные структуры - кристаллические решетки, - так и беспорядочное нагромождение - аморфные тела (именно такова структура полимеров, которые похожи на перепутанные и слипшиеся макароны в миске).
Выше были описаны три классических агрегатных состояния вещества. Имеется, однако, и четвертое состояние, которые физики склонны относить к числу агрегатных. Это плазменное состояние. Плазма характеризуется частичным или полным срывом электронов с их атомных орбит, при этом сами свободные электроны остаются внутри вещества.
Итак, подведем итоги:
Твердое тело имеет собственную форму и сохраняет свой объем .



