В чем заключается закон электролиза. Законы электролиза
Как уже известно, при электролизе на электродах происходит выделение вещества. Попробуем выяснить, от чего будет зависеть масса это вещества. Масса выделившегося вещества m будет равна произведению массы одного иона m0i на число ионов Ni, которые достигли электрода за промежуток времени равный ∆t: m = m0i*Ni. Масса иона m0i будет вычисляться по следующей формуле:
- m0i = M/Na,
где М - молярная масса вещества, а Na - постоянная Авогадро.
Число ионов, которые достигнут электрода, вычисляется по следующей формуле:
- Ni = ∆q/q0i,
где ∆q = I*∆t - заряд, прошедший через электролит за время, равное ∆t, q0i - заряд иона.
Для того, чтобы определить заряд иона, используется следующая формула:
- q0i = n*e,
где n - валентность, e - элементарный заряд.
Собирая воедино все представленные формулы, получаем формулу для вычисления массы выделившегося на электроде вещества:
- m = (M*I*∆t)/(n*e*Na).
Теперь обозначим через k коэффициент пропорциональности между массой вещества и зарядом ∆q.
- k = M/(e*n*Na).
Этот коэффициент k будет зависеть от природы вещества. Тогда формулу массы вещества можно переписать в следующем виде:
- m = k*I*∆t.
Второй закон Фарадея
Масса вещества, выделившегося на электроде за время, равное ∆t, при прохождении электрического тока пропорциональна силе тока и времени. Коэффициент k называют электрохимическим эквивалентом данного вещества. Единицей измерения служит кг/Кл. Разберемся с физическим смыслом электрохимического эквивалента. Так как:
- M/Na = m0i,
- e*n = qi,
то формулу электрохимического эквивалента можно переписать в следующем виде:
- k = m0i/q0i.
Таким образом, k - отношение массы иона к заряду этого иона.
Для того, чтобы удостовериться в справедливости закона Фарадея, можно провести опыт. Лабораторная установка, необходимая для него, показана на следующем рисунке.
Все три емкости заполнены одинаковым электролитическим раствором. Через них будут протекать различные электрические токи, причем I1 = I2+I3. После включения установки в цепь подождем некоторое время. Потом отключим её и измерим массы веществ, выделившихся на электродах в каждом из сосудов m1, m2, m3. Можно будет убедиться, что массы веществ будут пропорциональны силам тока, которые проходили через соответствующий сосуд.
Из формулы
- m = (M*I*∆t)/(n*e*Na)
можно выразить значение заряда электрона
- e = (M*I*∆t)/(n*m*Na).
Именно таким способом было впервые получено значение элементарного электрического заряда.
Нужна помощь в учебе?

Предыдущая тема: Электрический ток в жидкостях: ионная проводимость и электролиз
Следующая тема: Электрический ток в газах: опыт и проводимость газа
Эти законы определяют соотношение между массой продукта, образующегося на электроде, и количеством электричества (электрическим зарядом), пропущенным через электролит.
Первый закон Фарадея гласит, что масса вещества, образующегося на электроде, пропорциональна количеству пропущенного электричества. Количественной мерой электрического заряда является единица фарадей. Фарадей - это заряд, который несет на себе один моль электронов или один моль однозарядных ионов.
Напомним, что число - это число Авогадро (см. разд. 4.2).
Разряд ионов серебра на катоде в процессе электролиза раствора нитрата серебра описывается уравнением полуреакции
![]()
Следовательно, электрический заряд в 1 фарадей (один моль электронов) разряжает 1 моль ионов серебра, в результате чего образуется 1 моль атомов серебра. Это означает, что пропускание заряда в 2 фарадея приведет к образованию 2 молей атомов серебра, пропускание 3 фарадеев заряда приведет к образованию 3 молей атомов серебра и т.д.
Второй закон Фарадея гласит, что для разряда одного моля какого-либо иона на электроде необходимо пропустить через электролит такое число фарадеев заряда, которое равно числу элементарных зарядов на этом ионе.
Моль 2 моля 1 моль Таким образом, для разряда одного моля ионов на катоде через него необходимо пропустить 2 фарадея заряда (2 моля электронов).
Моль 3 моля I моль
Для разряда одного моля ионов алюминия на катоде через него необходимо пропустить 3 фарадея заряда (3 моля электронов).
Моля 1 моль 2 моля
Для получения одного моля молекул брома в результате разряда двух молей ионов брома на аноде через него необходимо пропустить 2 фарадея заряда. Следовательно, для разряда одного моля ионов брома необходим один фарадей заряда.
Фарадей не смог получить в детстве систематического образования. В возрасте 14 лет он стал помощником переплетчика. Но вскоре он заинтересовался наукой и, прослушав лекцию знаменитого химика Гемфри Дэви, написал ему и отправил свои записи лекции. Дэви принял его ассистентом в свою лабораторию в Королевском институте в Лондоне. Фарадею было в то время 21 год.

Майкл Фарадей читает рождественскую лекцию в Королевском институте (Лондон, 1955 г.) в присутствии членов королевской семьи: лицом к нему в первом ряду - муж королевы, слева от него - принц Уэльский (впоследствии Эдуард VII), справа от него - герцог Эдинбургский.
В последующие годы Фарадей открыл два новых хлорида углерода. Ему удалось также перевести в жидкое состояние хлор и другие газы. В 1825 г. он сумел выделить бензол и в том же году был назначен заведующим лабораторией. В течение нескольких лет он занимался экспериментальным изучением электролиза и в конце концов сформулировал в 1834 г. свои знаменитые законы электролиза. К этому времени он уже открыл явление электромагнитной индукции.
Фарадей стал президентом Королевского общества и написал несколько книг, в том числе «Экспериментальные исследования по химии и физике» (1858). В 1855 г. из-за ухудшения памяти он вынужден был прекратить исследовательскую работу. В 1867 г. Фарадей умер.
Первый закон Фарадея:
Масса вещества,
выделяющегося на электродах, прямо пропорциональна количеству прошедшего
через раствор электричества
Второй закон Фарадея:
При прохождении
через расплав или раствор электролита 96500 Кл электричества на
электродах выделяется 1 моль эквивалента вещества.
Электрохимический эквивалент вещества.
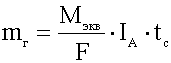 - объединённый
закон Фарадея.
- объединённый
закон Фарадея.
Поляризация при электролизе
Поляризация при электролизе складывается из собственно поляризации, которая делится на химическую и концентрационную, и перенапряжения.
Химическая поляризация
Химическ ая п оляризация возникает при использовании инертных электродов.
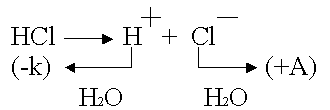 .
.
Какими бы ни были инертные электроды (Pt, С, керамика), все они
прекрасно адсорбируют газы.
Платина – анод насыщается хлором; платина – катод поглощает водород.
Хлор может только восстанавливаться, водород - окисляться:
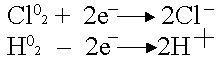 .
.
В электролизере образуется гальванический элемент:
.
Электродвижущая сила возникшего гальванического элемента направлена
против внешнего напряжения и ослабляет его.
Данный вид поляризации называется химическим по той причине, что
электроды как бы меняют свою химическую природу.
Поляризация играет отрицательную роль, так как она приводит к перерасходу
электроэнергии.
С химической поляризацией борются химическим путем. В раствор добавляют
вещества, которые очищают электроды от поглощённых газов.
Концентрационная поляризация
Данная поляризация происходит при активном аноде, например, серебряном
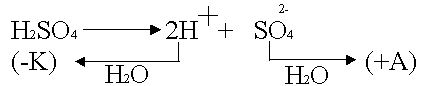
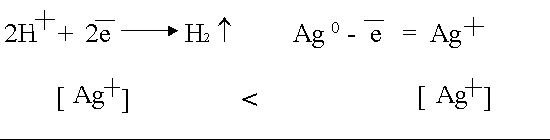 .
.
В силу диффузии ионы серебра от анода стремятся к катоду, где они начнут восстанавливаться как более сильные окислители.
Поскольку диффузия в жидкостях медленная, концентрация ионов Ag
в анодном пространстве намного выше, чем в катодном.
Вследствие этого в электролизере возникает концентрационный гальванический
элемент.
ЭДС возникшего концентрационного элемента также направлена против внешнего напряжения и ослабляет его.
С концентрационной поляризацией бороться гораздо проще, чем с химической.
Ее устраняют перемешиванием раствора.
Перенапряжение электрода
Перенапряжением электрода называют разность между фактическим и теоретическим электродными потенциалами.
Перенапряжение металлов настолько мало, что им пренебрегают. Велико
перенапряжение водорода и кислорода.
Перенапряжение водорода велико при следующих условиях:
- малых плотностях тока,
- низких температурах раствора.
Перенапряжение также зависит от материала катода.
Перенапряжение водорода наиболее велико на тех металлах, которые
в ряду напряжений располагаются вблизи водорода.
Перенапряжение водорода может играть как отрицательную, так и положительную
роль.
Отрицательную роль оно играет при необходимости получить водород электролитическим путем.
Положительна роль перенапряжения при необходимости получить с помощью электролиза какой - либо металл, находящийся в ряду напряжений до водорода.
Можно создать условия (плотность тока, температура раствора, материал
катода, посторонние ионы в растворе), при которых вследствие высокого
перенапряжения водорода из раствора можно восстановить металлы,
стоящие в ряду напряжения до водорода, (вплоть до алюминия).
Электрохимия - это раздел физической химии, в котором изучают физико-химические свойства ионных систем, а также процессы и явления на границах раздела фаз с участием заряженных частиц.
Проводники электрического тока делятся на электронные (проводники первого рода) и ионные (проводники второго рода).
Проводники первого рода - металлы в твердом и расплавленном состоянии. В них электрический ток осуществляется движением электронов электронного газа. При этом прохождение электрического тока в проводниках первого рода не сопровождается химическими изменениями их материала.
Проводники второго рода - некоторые растворы солей, кислот и оснований, а также некоторые вещества, главным образом соли, в расплавленном состоянии. Электрический ток в них осуществляется движением ионов (как положительных, так и отрицательных).
Электролиты - это химические соединения, которые в растворе (полностью или частично) диссоциируют на ионы. Диссоциация приводит к разъединению, отрыву ионов от молекулы или кристалла в результате взаимодействия ионов с молекулами растворителя.
Молекулы растворителей, обладающих хорошей диссоциирующей способностью, являются сильно полярными, и, следовательно, такие растворители имеют высокую диэлектрическую проницаемость.
Под действием электрических полей, создаваемых ионами электролита, полярные молекулы растворителя притягиваются ионами, ориентируются около них и в свою очередь, притягивая ионы к себе, ослабляют связь между ионами.
Подобным же образом они действуют и на ионы, составляющие решетку, например, ионного кристалла. Число ионов каждого знака определяется стехиометрическими коэффициентами в формуле электролита при соблюдении закона электронейтральности - сумма положительных зарядов равна сумме отрицательных. Таким образом, несмотря на наличие ионов, раствор электролита остается электронейтральным.
Электростатическое взаимодействие иона электролита с молекулами растворителя - сольватация - приводит к образованию вокруг иона молекулярного комплекса - сольвата. Совокупность молекул растворителя, окружающих ион, представляет собой сольватную оболочку. Сольватацию в водных растворах называют гидратацией.
Различают сильные и слабые электролиты.
Сильные электролиты диссоциируют в растворе почти полностью. В водных растворах сильными электролитами являются многие минеральные кислоты (HN0 3 , НС1, НС10 4 и др.), основания (щелочи), большинство солей.
Слабые электролиты диссоциируют в растворе только частично. К слабым электролитам в водных растворах относятся почти все органические кислоты и основания.
Сильные и слабые электролиты являются двумя различными состояниями химических соединений (электролитов) в зависимости от природы растворителя. В одном растворителе данный электролит может быть сильным электролитом, в другом - слабым.
Процесс диссоциации слабых электролитов является обратимым, поскольку ионы противоположного знака, встречаясь в растворе, могут вновь соединяться в молекулы.
Рассмотрим простейший случай слабого сильно разбавленного бинарного одно-одновалентного электролита, диссоциирующего по схеме
МА <=> М + + А -
Важные характеристики электролита:
Степень диссоциации α - доля продиссоциировавших молекул из числа первоначально взятых
Константа диссоциации K d , которую, для данного случая можно представить (используя закон действующих масс - при постоянной температуре скорость данной реакции прямо пропорциональна произведению концентраций реагирующих веществ, причем каждая из концентраций участвует в степени, в простейших случаях равной коэффициенту перед формулой данного вещества в уравнении реакции) в виде
Например,
![]()
Если , то ![]() , при малых значениях a<0,03, (1-a) » 1, следовательно - это математическое выражение закона разбавления Оствальда
, который звучит следующим образом:
, при малых значениях a<0,03, (1-a) » 1, следовательно - это математическое выражение закона разбавления Оствальда
, который звучит следующим образом:
Степень диссоциации слабого электролита в растворе тем выше, чем более разбавлен раствор, т.е. в бесконечно разбавленном растворе степень диссоциации любого электролита равна 1.
Взаимное превращение электрической и химической форм энергии происходит в электрохимических системах, состоящих из:
1)проводников второго рода (/) -электролитов,
2) проводников первого рода (//), (///), находящихся в контакте с электролитом.
3) проводников (IV) - внешняя цепь - обеспечивающих прохождение тока между проводниками (7/)и {III). На границе раздела двух фаз (/ - // и I - III) происходит перенос электрического заряда - протекает электрохимическая реакция.
Анодом называется электрод, на котором происходит реакция окисления (Oxidation)
Катодом называется электрод, на котором происходит реакция восстановления (Reduction). Соответственно, в электрохимии реакции восстановления принято называть катодными, окисления - анодными.
В химическом источнике электрического тока - гальваническом элементе - энергия химического процесса переходит в электрическую.
Соотношение между количеством электричества и массами прореагировавших веществ в электрохимических реакциях на электродах выражается законами Фарадея.
1-й закон Фарадея. Масса вещества т, претерпевшего химическое превращение под действием электрического тока, пропорциональна количеству протекшего электричества q
т = k 3 q
где к э - электрохимический эквивалент (г/Кл) - масса прореагировавшего вещества при протекании 1 кулона электричества.
2-й закон Фарадея . При прохождении через различные электролиты одного и того же количества электричества массы различных веществ, участвующих в электродных реакция, пропорциональны их молярным массам эквивалентов (М экв):
т х: т 2: т ъ = М экв ] : М экв 2: М экв 3
Следствие. Для электрохимического превращения 1 моль-экв любого вещества требуется одинаковое количество электричества F = eN A - 96485 Кл/моль-экв
(или 26,8 А ч/моль-экв), называемое постоянной Фарадея.
Уравнение, объединяющее оба закона Фарадея:
где М - молярная масса вещества, 1 - сила тока, t - время процесса, z - число электронов, участвующих в электрохимической реакции.
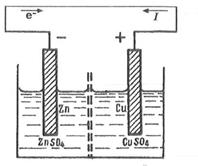 Рассмотрим превращение химической энергии в электрическую на примере гальванического элемента Даниэля-Якоби.
Рассмотрим превращение химической энергии в электрическую на примере гальванического элемента Даниэля-Якоби.
При схематической записи электрохимических систем используют следующие обозначения:
1. граница между электродом и раствором обозначается вертикальной сплошной чертой
2. граница между электролитами обозначается двумя вертикальными линиями.
Элемент Даниэля-Якоби состоит из цинкового и медного электродов, опущенных соответственно в растворы сульфатов цинка и меди, разделенных пористой диафрагмой во избежание их перемешивания.
Правило записи схем электрохимических элементов.
ЭДС электрохимического элемента считается положительной, если электрохимическая цепь записана так, что катионы при работе элемента проходят в растворе от левого электрода к правому и в том же направлении движутся электроны во внешней цепи. Схема элемента Даниэля-Якоби
(-)Zn|ZnSQ 4 ||CuS0 4 |Си(+)
При погружении металла в раствор ионы металла под действием сильно полярных молекул воды начинают переходить в слой воды, прилегающий к поверхности металла.
При этом приповерхностный слой металла обедняется катионами, приобретает избыточный отрицательный заряд, и между ним и катионами в растворе возникает разность потенциалов, препятствующая дальнейшему выходу катионов из металла - устанавливается равновесие.
В элементе Даниэля-Якоби цинковый электрод, обладающий более высокой способностью выделять ионы в раствор, чем медь, приобретает более высокий отрицательный заряд. Если соединить электроды металлическим проводником, то избыточные электроны будут переходить с цинковой пластинки на медную.
Это нарушает равновесие на поверхности каждого из электродов. На цинковом электроде (отрицательном полюсе элемента - аноде) продолжается окисление цинка Zn = Zn 2+ + 2е~.
На медном электроде (положительном полюсе элемента - катоде) продолжается восстановление меди Си 2+ + 2е~ = Си.
Таким образом реализуется самопроизвольно протекающий процесс, в котором цинковая пластинка растворяется, на медной выделяется металлическая медь, а во внешней цепи протекает электрический ток. Суммарная окислительно-восстановительная реакция:
Cu 2+ + Zn -> Си + Zn 2+
С другой стороны, если при протекании химической реакции на каждом электроде выделяется или растворяется z моль-эквивалентов вещества (согласно закону Фарадея, во внешней цепи протекает zF Кл электричества), то максимальная работа, которую совершает гальванический элемент по перенесению заряда zF между электродами с разностью потенциалов Е равна zFE.
Электродвижущей силой (ЭДС) элемента Е называется разность потенциалов между полюсами обратимого электрохимического элемента.
![]() ,
,
где R – газовая постоянная,
F – число Фарадея (96 500 Кл/моль),
n – число электронов участвующих в процессе.
При температуре 298 К данное уравнение принимает следующий вид:
![]() .
.
где Е - условный стандартный электродный потенциал по водородной шкале.
Для определения равновесного электродного потенциала по водородной шкале составляют элемент из этого электрода и стандартного водородного электрода. Который представляет собой платиновую нить, погруженную в
электролит, вдоль которой пропускается газообразный водород, H + |H 2 ,Pt) с
активностью водородных ионов в растворе равной единице и давлением водорода равном 1 атм. Его потенциал при любой температуре условно принят равным нулю.
При этом: стандартный водородный электрод располагают слева.
Например, для определения потенциала цинкового электрода составляют электрохимическую цепь
Pt,H 2 |H + ||Zn 2+ |Zn
Электродная реакция записывается как реакция восстановления, т.е. присоединения электронов: в данном примере на водородном (левом)
электроде 2H + +2e~=H 2 , на цинковом (правом) электроде Zn 2+ +2е~ =Zn. Общая реакция записывается как разность между реакциями на правом и левом элементах
Н 2 + Zn 2+ = 2Н + + Zn
Стандартный электродный потенциал считается положительным, если электрод заряжен более положительно, чем стандартный водородный электрод. В этом случае электрический ток будет течь внутри элемента слева направо и ЭДС элемента будет положительной.
Стандартный электродный потенциал считается отрицательным, если электрод заряжен более отрицательно, чем стандартный водородный электрод. В этом случае электрический ток будет течь внутри элемента справа налево и ЭДС элемента будет отрицательной.
В рассматриваемом примере Н 2 + Zn 2+ = 2Н + + Zn ток в элементе будет течь от цинкового электрода к водородному (справа налево) и ЭДС элемента так же, как и равный ей потенциал цинка, будет иметь отрицательный знак.
Стандартные электродные потенциалы, определенные по водородной шкале при 25 С (298 К) обычно располагают в ряд. Например
>>Физика 10 класс >>Физика: Закон электролиза
При электролизе на электродах происходит выделение вещества. От чего зависит масса вещества, выделяющегося за определенное время? Это определяет закон электролиза.
Очевидно, что масса выделившегося вещества m
равна произведению массы одного иона m 0i
на число ионов достигших электрода за время :
Масса иона m 0i
согласно формуле (8.4) равна:

где М
- молярная (или атомная) масса вещества, а N A
- постоянная Авогадро, т. е. число ионов в одном моле.
Число ионов, достигших электрода, равно:

где - заряд, прошедший через электролит за время ; - заряд иона, который определяется валентностью n
атома: ![]() (е
- элементарный заряд).
(е
- элементарный заряд).
При диссоциации молекул, состоящих из одновалентных атомов (n
= 1), возникают однозарядные ионы. Например, при диссоциации молекул КВr возникают ионы K + и Вr. Диссоциация молекул медного купороса ведет к появлению двухзарядных ионов Cu 2+ и SO 4 2- , так как атомы меди в данном соединении двухвалентны (n
= 2). Подставляя в формулу (16.3) выражения (16.4) и (16.5) и учитывая, что , получаем
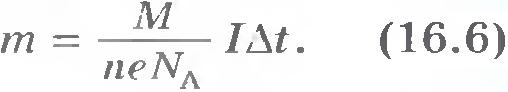
![]()
Коэффициент k
зависит от природы вещества (значений М
и n
). Согласно формуле (16.6) имеем:
Следовательно, масса вещества, выделившегося на электроде за время при прохождении электрического тока, пропорциональна силе тока и времени
.
Это утверждение, полученное нами теоретически, впервые было установлено экспериментально Фарадеем и носит название закона электролиза Фарадея
.
Из формулы (16.8) видно, что коэффициент k
численно равен массе вещества, выделившегося на электродах, при переносе ионами заряда, равного 1 Кл. Величину k
называют электрохимическим эквивалентом
данного вещества и выражают в килограммах на кулон
(кг/Кл).
Электрохимический эквивалент имеет простой физический смысл. Так как 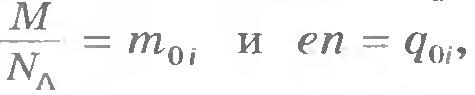 , то согласно формуле (16.7)
, то согласно формуле (16.7) 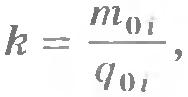 , т. е. k
- отношение массы иона к его заряду.
, т. е. k
- отношение массы иона к его заряду.
Измеряя величины m
и , можно определить электрохимические эквиваленты различных веществ.
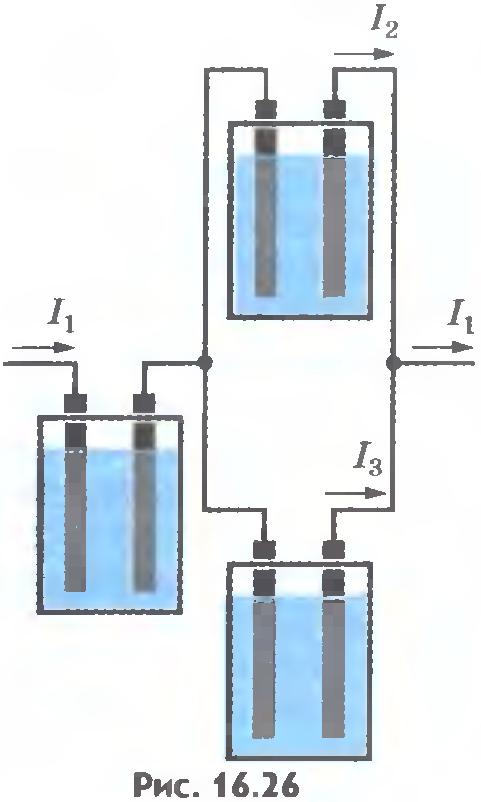
Убедиться в справедливости закона Фарадея можно на опыте. Соберем установку, показанную на рисунке 16.26. Все три электролитические ванны заполнены одним и тем же раствором электролита, но токи, проходящие через них, различны. Обозначим силы токов черезI 1 , I 2 , I 3
. Тогда I 1 = I 2 + I 3
. Измеряя массы m 1 , m 2 , m 3
веществ, выделившихся на электродах в разных ваннах, можно убедиться, что они пропорциональны соответствующим силам токов I 1 , I 2 , I 3
.
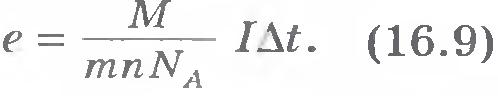
Зная массу m
выделившегося вещества при прохождении заряда , молярную массу М
, валентность атомов n
и постояннуюАвогадро N A
, можно найти значение модуля заряда электрона. Оно оказывается равным е = 1,6 10 -19 Кл.
Именно таким путем и было впервые в 1874 г. получено значение элементарного электрического заряда.
Произведение силы тока на время определяет массу вещества, выделяемого при электролизе. Закон электролиза позволяет найти значение элементарного электрического заряда.
???
1. Сформулируйте закон электролиза Фарадея.
2. Почему отношение массы вещества, выделившегося при электролизе, к массе иона равно отношению прошедшего заряда к заряду иона?
Г.Я.Мякишев, Б.Б.Буховцев, Н.Н.Сотский,



