Степень разрушения структур белка таблица. Качественные особенности живой материи. Уровни организации живого
Среди сложных биополимеров по функциональному значению и в количественном соотношении главная роль принадлежит белкам. В животной клетке они составляют 40-50% ее сухой массы, в растительной - 20-- 35%. Огромное разнообразие живых существ в значительной степени определяется различиями в составе их белков. Только в организме человека их насчитывается более 5 миллионов типов. Причина такого многообразия белков объясняется спецификой их строения.Белки представляют собой полимеры, мономерами которых являютсяаминокислоты. Известно 20 видов аминокислот, входящих в состав молекул белков Их называют основными, с тем чтобы отличить от других аминокислот также присутствующих в организмах, но не входящих в состав белковых молекул. Все эти аминокислоты в составе своих молекул имеют одинаковую структуру атомов
Н-С-СООН, где СООН - карбоксильная группа, a nh 2 -
аминогруппа.
Четвертая валентная связь углерода занята так называемым радикалом (R). Радикалы различных видов аминокислот отличаются друг от друга по химической структуре, электрическим зарядам, а также по способности растворяться в воде. Аминокислоты являются амфотерными соединениями, т. е. одна и та же аминокислота может выступать как в роли кислоты, так и в роли щелочи. Кислотные свойства ей придает карбоксильная группа (СООН), а щелочные - аминогруппа (NH 2). Благодаря амфотерности аминокислоты могут взаимодействовать друг с другом, причем одна из них выступает в роли кислоты, а другая - в роли щелочи; карбоксильная группа одной аминокислоты взаимодействует с аминогруппой другой). Соединение аминокислот в почку белка осуществляется за счет прочных ковалентных связей. Этот процесс можно записать при помощи такого уравнения:
Образовавшееся соединение аминокислот называется пептидом, а ковалентная связь между ними - пептидной связью. Все белки представляют собой полипептиды, т. е. цепи, состоящие из многих десятков и даже сотен аминокислотных звеньев. Из 20 видов аминокислот можно построить огромное количество белков, точно так же как из 20 букв алфавита можно составить множество слов, смысл которых будет зависеть от того, из каких букв они составлены, в каком количестве взяты и в каком порядке установлены. Свойства же молекулы белка определяются составом аминокислот, числом аминокислотных звеньев, а также порядком их следования в цепи.
Последовательность аминокислотных остатков в молекуле белка определяет егопервичную структуру (рис. 1-I). Если учесть, что размер одного аминокислотного звена равен 0,35-0,37 нм, то очевидно, что макромолекула белка, которая состоит из сотен аминокислотных остатков, должна была бы иметь в длину несколько десятков нанометров. В действительности же размеры белков гораздо меньше, потому что в пространстве полипептидная цепь полностью или частично закручена в спираль, которая представляет собойвторичную структуру белка (рис. 1-II). Аминокислотные радикалы остаются при этом снаружи спирали, а между NH-группами, находящимися на одном витке, и СО-группами, находящимися на соседнем витке спирали, образуются водородные связи. Они значительно слабее ковалентных, но, повторенные многократно, дают прочное сцепление. Полипептидная спираль, «прошитая» многочисленными водородными связями, представляет собой достаточно прочную структуру. Полипептидная спираль подвергается дальнейшей укладке - она сворачивается причудливо, но для каждого белка вполне определенно и постоянно в так называемую глобулу (шарик), которая и представляет собойтретичную структуру молекулы белка (рис. 1-III).
Третичная структура белка поддерживается связями трех типов: ионными, водородными и дисульфидными, а также гидрофобными взаимодействиями. В количественном отношении наиболее важны гидрофобные взаимоотношения: в водной среде клетки гидрофобные радикалы, отталкиваются друг с другом. Таким образом, водная среда как бы принуждает белковую молекулу принять определенную упорядоченную структуру, которая становится биологически активной.
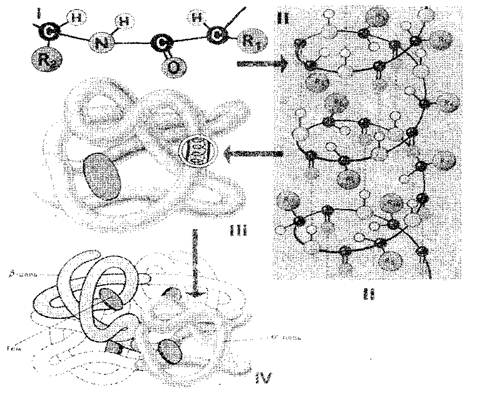
Рис. 1. Схема строения белковой клетки: I, II, III, IV - первичная, вторичная, третичная, четвертичная структуры
Белки, состоящие из одной полипептидной цепи, имеют только третичную структуру. Однако некоторые белки построены из нескольких полипептидных цепей. Для них введено понятиечетвертичной структуры (рис. 1-IV), которая представляет собой единую функциональную единицу удерживаемую за счет как гидрофобных взаимодействий, так и водородных и ионных связей. Четвертичная структура характерна, например, для гемоглобина. Его молекула состоит из четырех отдельных полипептидных цепей. Некоторые вирусы, например, вирус мозаики табака, имеет белковую оболочку, состоящую из многих полипептидных цепей, упакованных высокоупорядоченным образом.
Под действием различных физико-химических факторов (действия концентрированных кислот и щелочей, тяжелых металлов, высокой температуры и т. п.) структура, а значит, и свойства белковых молекул могут изменяться. Процесс нарушения природной структуры белка или разворачивание полипептидной цепи без нарушения пептидных связей называется денатурацией белка (рис. 2). Как правило, денатурация носит необратимый характер, однако, на первых стадиях, при условии приостановки действия негативных факторов, белок может восстанавливать свою первоначальную структуру – этот процесс носит название ренатурации белка. Процесс разрушения первичной структуры белка всегда необратим, он называется деструкцией белка.
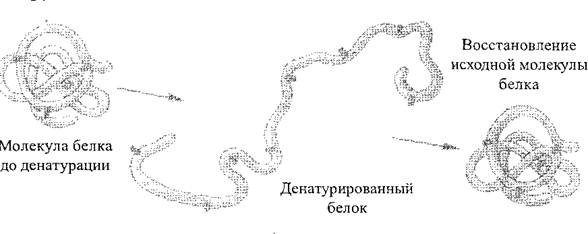
Рис. 2. Схема процесса денатурации белка
Физические и химические свойства белков очень разнообразны: существуют белки гидрофильные и гидрофобные, одни из них легко изменяют свою структуру в результате даже незначительного воздействия факторов внешней среды, другие оказываются стойкими по отношению к этим факторам. По физико-химическим свойствам белки делятся на простые (протеины) и сложные (протеиды).
Простые белки состоят исключительно из остатков аминокислот, сложные же включают в себя еще и соединения другой природы, такие как остатки фосфорной и нуклеиновых кислот, углеводов, липидов и др.
Биологические функции белков чрезвычайно разнообразны. Прежде всего они выполняютстроительную функцию. Белки являются составной частью клеточных мембран, из них состоят такие немембранные органеллы клетки, как микротрубочки и микронити, составляющие скелет клетки (цитоскелет). Из белков, обладающих прочностью и эластичностью, состоят хрящи, сухожилия, связки. Из прочного и нерастворимого белка кератина построены ногти, перья. Помимо строительной, белки выполняют еще и защитную функцию, которая заключается, как в предотвращении повреждений клеток, органов и организма в целом, так и в защите организма от паразитов и чужеродных белков. В организме позвоночных животных образуются защитные белки - антитела. Это специализированные белки, которые вырабатываются лимфоцитами крови. Они способны «распознавать» и обезвреживать бактерии, вирусы, чужеродные для организма белки. Белок крови фибрин обуславливает ее свертывание, защищая организм от больших кровопотерь.
Регуляторная функция белков заключается в способности регулировать активность обмена веществ при помощи гормонов белковой природы, а также белков-ферментов. Белки выполняют исигнальную функцию. Она заключается в способности отдельных сложных белков, входящих в состав клеточной мембраны, «распознавать» специфические химические соединения и определенным образом на них реагировать: связывать их, изменяя свою структуру, передавать сигналы о присутствии этих веществ в другие участки мембраны или внутрь клетки. Благодаря сигнальной функции белков, клетка может избирательно поглощать вещества из внешней среды.
Двигательная функция белков заключается в способности некоторых из них сокращаться, обеспечивая тем самым возможность клетки, ткани, организма в целом изменять свою форму, двигаться. Так, за счет таких белков как актин и миозин, входящих в состав мышечных клеток, мышечное волокно укорачивается; белок турбулин, из которого состоят микротрубочки и микронити, обеспечивает движение ресничек и жгутиков эукариотических клеток.
Некоторые белки могут откладываться клеткой про запас, выполняя тем самымзапасающую функцию.
В эндосперме семян многих видов растений (пшеницы, кукурузы, риса) есть белки, которыми зародыш питается на первых этапах своего развития. Функцию этих белков можно определить какпитательную.
Белки способны осуществлятьтранспорт некоторых веществ как внутри клетки, так и внутри организма. Например, белок крови человека и позвоночных животных гемоглобин транспортирует кислород от органов дыхания к клеткам, а углекислый газ - в обратном направлении.
Энергетическая функция белков состоит в том, что при их расщеплении в клетке освобождается энергия. Часть аминокислот, которые образуются при расщеплении, используется для биосинтеза новых белков, а остальные - расщепляются до конечных продуктов распада с освобождением энергии (при полном расщеплении 1 г белков в среднем освобождается 17,2 кДж энергии).
Одна из основных функций белка -ферментативная. Ферменты - это биологические катализаторы или ускорители химических реакций, проходящих в живом организме. Как известно, скорость химических реакций существенным образом зависит от концентрации веществ, а также температуры среды, в которой эти реакции протекают. Если учесть, что жизнь клетки (организма) - это совокупность огромного количества реакций синтеза и распада, которые составляют обмен веществ, то становится понятной огромная роль белков-ферментов в процессах жизнедеятельности организма на всех его уровнях. Только благодаря ферментам, при сравнительно низкой температуре организма и малой концентрации веществ в его клетках и тканях химические реакции протекают с достаточно большой скоростью (ферментативная реакция протекает в 100-1000 раз быстрее, нежели в среде без ферментов). Каталитическую активность белка-фермента обуславливает не вся молекула, а только ее небольшая часть, называемая активным центром. Пространственная структура активного центра как ключ к замку подходит по форме к пространственной структуре катализируемого вещества (субстрата), именно этим объясняется специфичность белков-ферментов (рис. 3).
При денатурации белковой молекулы нарушается структура активного центра, и фермент теряет свою каталитическую способность. Так, белок-фермент каталаза, обуславливающий реакцию расщепления пероксида водорода (Н 2 О 2) до кислорода и воды утрачивает свою каталитическую активность после воздействия на него высокой температурой. Вот почему капля пероксида водорода, нанесенная на ломтик сырого картофеля, содержащего большое количество каталазы, «вскипает», а на вареном картофеле - остается без изменения.
Белки-ферменты, обуславливая прохождение химических реакций, сами при этом остаются без изменений, их иногда сравнивают с иглой, которая соединяя два куска ткани воедино, сама при этом остается без изменения.
Ферменты расположены определенным образом как в клетке, так и в организме в целом. В клетке ферменты часто связаны с ее мембранами или мембранами отдельных органелл (митохондрий, пластид и т. п.). Действие на организм лекарственных препаратов, гормонов, ядов состоит в том, что они могут стимулировать или, наоборот, угнетать тот или иной ферментативный процесс.
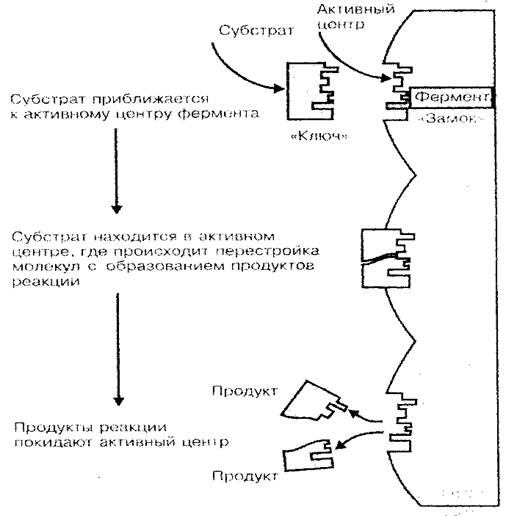
Рис. 3 Схема связывания фермента с субстратом
Организмы способны регулировать биосинтез ферментов. Это делает возможным поддержание относительного постоянства их химического состава, независимо от постоянно меняющихся условий среды.
Специфичность первичной структуры белка. Особенности образования пептидной связи. Определяющая роль первичной структуры в формировании более высоких уровней организации белковой молекулы.
Первичная структура белка.
Первичной структурой белков называется линейная полипептидная цепь из аминокислот, соединенных между собой пептидными связями. Первичная структура - простейший уровень структурной организации белковой молекулы. Высокую стабильность ей придают ковалентные пептидные связи между α-аминогруппой одной аминокислоты и α-карбоксильной группой другой аминокислоты.
Если в образовании пептидной связи участвует иминогруппа пролина или гидроксипролина, то она имеет другой вид.
При образовании пептидных связей в клетках сначала активируется карбоксильная группа одной аминокислоты, а затем она соединяется с аминогруппой другой. Примерно так же проводят лабораторный синтез полипептидов.
Пептидная связь является повторяющимся фрагментом полипептидной цепи. Она имеет ряд особенностей, которые влияют не только на форму первичной структуры, но и на высшие уровни организации полипептидной цепи:
Копланарность - все атомы, входящие в пептидную группу, находятся в одной плоскости;
Способность существовать в двух резонансных формах (кето- или енольной форме);
Транс-положение заместителей по отношению к С-N-связи;
Способность к образованию водородных связей, причем каждая из пептидных групп может образовывать две водородные связи с другими группами, в том числе и пептидными.
Исключение составляют пептидные группы с участием аминогруппы пролина или гидроксипролина. Они способны образовывать только одну водородную связь (см. выше). Это сказывается на формировании вторичной структуры белка. Полипептидная цепь на участке, где находится пролин или гидроксипролин, легко изгибается, так как не удерживается, как обычно, второй водородной связью.
4.Вторичная структура белка . Связи, стабилизирующие вторичную структуру, α-спираль. Факторы, нарушающие спирализацию. β-складчатая структура, особенности конформационного строения.
Вторичная структура белка – конфигурация полипептидной цепи, т.е. способ укладки полипептидной цепи в определенную конформацию.
Процесс этот протекает не беспорядочно, а в соответствии с первичной структурой белка.
Вторичная структура поддерживается в основном водородными связями, хотя для некоторых белков определенный вклад вносят пептидные и дисульфидные ковалентные связи.
Наиболее вероятным типом вторичной структуры глобулярных белков является -спираль. Закручивание полипептидной цепи в спираль происходит по часовой стрелке. Для каждого белка характерна определенная степень спирализации. Так, полипептидные цепи гемоглобина спирализованы на 75%, а молекула пепсина - на 30%.
Тип конфигурации полипептидных цепей, когда сегменты пептидной цепи располагаются в один слой, образуя структуру, подобную листу, сложенному в гармошку, называется -структурой. Такой тип вторичной структуры обнаружен в белках мышц, волос, шелка. -Слой может быть внутримолекулярным, а также образованным двумя или более полипептидными цепями.
Способность к образованию водородных связей, являющихся движущей силой при возникновении α- и β-структур в белковой молекуле, выражена у разных аминокислот в неодинаковой степени. Выделяют группу спиралеобразующих аминокислот: ала, глн, глу, лей, мет, лиз, гис. Вал, иле, тир, тре, фен способствуют образованию -структур полипептидной цепи. Наличие сер, гли, про, асн, асп приводит к преимущественному образованию неупорядоченных фрагментов в белковой молекуле.
В природе существуют белки, строение которых не соответствует ни
β-, ни -структуре (коллаген).
5.Третичная структура белка. Связи, стабилизирующие третичную структуру (ковалентные, ионные, гидрофобные, водородные, Ван-дер-Ваальса).
Третичная структура белка – пространственная ориентация полипептидной спирали или способ укладки полипептидной цепи в определенном объеме. Первый белок, Третичная структура белка (миоглобин кашалота) впервые была установлена методом рентгеноструктурного анализа (рис. 2).
В стабилизации пространственной структуры белков, помимо ковалентных связей, основная роль принадлежит нековалентным связям (межмолекулярные ван-дер-ваальсовы силы, водородные связи, электростатические взаимодействия ионизированных групп, гидрофобные взаимодействия и т.д.).
Методом рентгеноструктурного анализа установлено существование специфических уровней структурной организации белковой молекулы, промежуточных между вторичной и третичной структурами. Домен - это компактная глобулярная структурная единица внутри полипептидной цепи (рис. 3). Открыты белки (в частности, иммуноглобулины), в которых существуют различные по структуре и функциям домены.
Согласно современным представлениям, белка после окончания синтеза белка его третичная структура формируется самопроизвольно. Процесс формирования нативной пространственной структуры полипептидной цепи - фолдинг. Основной движущей силой фолдинга является взаимодействие радикалов аминокислот с молекулами воды. При этом гидрофобные радикалы аминокислот ориентируются внутрь белковой молекулы, а гидрофильные радикалы повернуты в сторону воды.
В клетках существуют белки, названные шаперонами. Их основная функция - участие в фолдинге (рис. 4). Описан ряд заболеваний человека, имеющих наследственную природу, возникновение которых связывают с нарушением процесса фолдинга вследствие мутаций (пигментозы, фиброзы и др.).
Все биологические свойства белков связаны с образованием и сохранностью третичной структуры, называемой нативной. Белковая глобула не является абсолютно жесткой структурой: возможны обратимые перемещения фрагментов полипептидной цепи. Эти изменения не приводят к нарушению общей конформации молекулы. Факторы, влияющие на конформацию белковой молекулы - ионная сила раствора, рН среды, взаимодействие с компонентами раствора. Любые воздействия, приводящие к нарушению нативной структуры молекулы, приводят к частичной или полной утрате белком его биологических свойств.
6.Четвертичная структура белка. Понятие о мономерах и олигомерах. Зависимость свойств белка от его конформации. Взаимосвязь структуры и функции.
Четвертичная структура белка - укладка отдельных полипептидных цепей, обладающих специфической первичной, вторичной или третичной структурой, в пространстве, и формирование единого макромолекулярного образования.
Белок, состоящий из нескольких полипептидных цепей, называют олигомером, а каждую входящую в него полипептидную цепь - протомером. Олигомерные белки, как правило, состоят из четного числа псубъединиц, например, молекула гемоглобина построена из двух - и двух -полипептидных цепей (рис. 5).
Четвертичную структуру имеют около 5% белков, такие как ферритин, иммуноглобулины. Субъединичное строение свойственно многим ферментам, в первую очередь тем, которые выполняют сложные функции. Почти все ДНК- и РНК-полимеразы имеют четвертичную структуру. Полипептидные цепи, входящие в состав белка с четвертичной структурой, образуются на рибосомах по отдельности. Только после завершения синтеза происходит их объединение в надмолекулярную структуру. Биологическую активность белок приобретает на уровне четвертичной структуры. Стабилизация четвертичной структуры происходит при участии тех же связей, что и при формировании третичной структуры, за исключением ковалентных связей.
Ряд исследователей признают наличие пятого уровня структурной организации белков. Полифункциональные макромолекулярные комплексы разных ферментов, катализирующие весь путь превращений субстрата, получили назвение метаболонов (пируватдегидрогеназный комплекс, синтетазы ВЖК, дыхательная цепь).
Белок, выполняющий специфическую функцию в метаболизме клетки, может быть представлен несколькими формами - изофункциональными белками, или изобелками. В эритроцитах крови человека обнаружено несколько форм гемоглобина: У взрослого человека преобладающей формой является НbА. Ч Для эмбриональной стадии развития человека характерен фетальный гемоглобин HbF. Все формы гемоглобинов выполняют функцию переноса кислорода из легких в ткани, однако свойства разных гемоглобинов отличаются.
Понятие нативный белок. Понятие об аллостерических белках.
Нативный белок - белок, обладающий определенной биологической активностью.
8.Основные функции простых и сложных белков в организме: структурная, каталитическая, рецепторная, регуляторная, транспортная, защитная, сократительная и другие.
Структурная функция. В комплексе с липидами белки участвуют в образовании биомембран клеток. Структурные белки цитоскелета придают форму клеткам и многим органоидам. Примерами структурных белков являются коллаген в соединительной ткани, кератин в волосах, коже, ногтях.
Сократительная (двигательная) функция. Сократительную функцию выполняют мышечные белки (актин и миозин). Белки цитоскелета необходимы для расхождения хромосом в процессе митоза.
Питательная (резервная) функция. Овальбумины(белки яйца) - источники питания для плода. Казеин - белок молока - также выполняет питательную функцию.
Каталитическая функция. Большинство известных в настоящее время ферментов (биологических катализаторов) является белками.
Транспортная функция. Белок эритроцитов гемоглобин участвует в переносе кислорода и углекислого газа, выполняя дыхательную функцию. Альбумины сыворотки крови участвуют в транспорте липидов.
Защитная функция. В ответ на поступление в организм вирусов, бактерий, чужеродных белков, токсинов образуются защитные белки - антитела (иммунная защита). Специфические белки плазмы крови способны к свертыванию, что предохраняет от кровопотери при кровотечениях (физическая защита).
Рецепторная функция. Клеточные белки образуют специфические рецепторы и участвуют в передаче гормонального сигнала.
Гормональная функция. Группа гормонов являются белками или полипептидами, например, гормон гипофиза вазопрессин.
Другие важные функции белков - буферные свойства (обеспечение физиологического значенияе рН внутренней среды), поддержаниеь онкотического давлениея в клетках и крови, и др.
В организме людей и животных содержание белка значительно выше, чем у растений. В мышцах, легких, селезенке, почках белками приходится более 70-80% сухой массы в печени - 57%, в мозге - 45%. Низкое содержание белка в кости и в зубах - 20 и 18%. Неодинаковое содержание белка и в разных субклеточных органеллах. Больше белка в гиалоплазме (внутриклеточный сок). Если принять общий белок клетки за 100%, то на гиалоплазму приходится 40%. Митохондрии и микросомы содержат по 20%, ядро - 12%, лизосомы - 2%, пероксисомы - 2,5%, плазматическая мембрана - 1,5% белка.
В состав некоторых белков входят фосфор (0,2-2%), железо и другие элементы. Наиболее постоянным для белков животного, растительного и микробного происхождения содержание азота - в среднем 16%, на этой основе по содержанию азота рассчитывают количество белка: массу азота, установленную анализом, умножают на коэффициент 6,25 (100:16 = 6,25) .
Размер белковых молекул лежит в пределах 1 мкм до 1 нм
Гель-фильтрация, или метод молекулярных сит
Для разделения белков часто используют хроматографические методы, основанные на распределении веществ между двумя фазами, одна из которых подвижная, а другая неподвижная. В основу хроматографических методов положены разные принципы: гель-фильтрации, ионного обмена, адсорбции, биологического сродства.
Метод разделения белков с помощью гель-фильтрационной хроматографии основан на том, что вещества, отличающиеся молекулярной массой, по-разному распределяются между неподвижной и подвижной фазами. Хроматографическая колонка заполняется гранулами пористого вещества (сефадекс, агароза и др.). В структуре полисахарида образуются поперечные связи и формируются гранулы с "порами", через которые легко проходят вода и низкомолекулярные вещества. В зависимости от условий можно формировать гранулы с разной величиной "пор".
Неподвижная фаза - жидкость внутри гранул, в которую способны проникать низкомолекулярные вещества и белки с небольшой молекулярной массой. Смесь белков, нанесённую на хроматографическую колонку, вымывают (элюируют), пропуская через колонку растворитель. Вместе с фронтом растворителя движутся и самые крупные молекулы.
Более мелкие молекулы диффундируют внутрь гранул сефадекса и на некоторое время попадают в неподвижную фазу, в результате чего их движение задерживается. Величина пор определяет размер молекул, способных проникать внутрь гранул (рис. 1-55).
Так как гелевая структура сефадекса легко деформируется под давлением, гели стали заменять более жёсткими матрицами (сефактил, той-оперл), представляющими сферические гранулы с разными размерами пор. Выбор размеров пор в гранулах зависит от целей хроматографии (о других хроматографических методах будет сказано ниже).
Ультрацентрифугирование
Метод разделения также основан на различии в молекулярных массах белков. Скорость седиментации веществ в процессе вращения в ультрацентрифуге, где центробежное ускорение достигает 100 000-500 000 g, пропорционально их молекулярной массе. На поверхность буферного раствора, помещённого в кювету, наносят тонкий слой смеси белков. Кювету помещают в ротор ультрацентрифуги. При вращении ротора в течение 10-12 ч более крупные молекулы (с большей молекулярной массой) оседают в буферном растворе с большей скоростью. В результате в кювете происходит расслоение смеси белков на отдельные фракции с разной молекулярной массой (рис. 1-56). После расслоения белковых фракций дно кюветы прокаливают иглой и по каплям собирают содержимое небольшими порциями в пробирки.
Нарушение природной структуры белка называют денатурацией. Она возникает под воздействием высокой температуры, химических веществ, лучистой энергии и др. факторов.
Роль белка в жизни клеток и организмов:
строительная (структурная) - белки - строительный материал организма (оболочки, мембраны, органоиды, ткани, органы);
каталитическая функция - ферменты, ускоряющие реакции в сотни ми
ллионов раз;
опорно-двигательная функция - белки, входящие в состав костей скелета, сухожилий; движение жгутиковых, инфузорий, сокращение мышц;
транспортная функция - гемоглобин крови;
защитная - антитела крови обезвреживают чужеродные вещества;
энергетическая функция - при расщеплении белков 1 г освобождает 17,6 кДж энергии;
регуляторная и гормональная - белки входят в состав многих гормонов и принимают участие в регуляции жизненных процессов организма;
рецепторная - белки осуществляют процесс избирательного узнавания отдельных веществ и их присоединение к молекулам.
Обмен веществ в клетке. Фотосинтез. Хемосинтез
Обязательным условием существования любого организма является постоянный приток питательных веществ и постоянное выделение конечных продуктов химических реакций, происходящих в клетках. Питательные вещества используются организмами в качестве источника атомов химических элементов (прежде всего атомов углерода), из которых строятся либо обновляются все структуры. В организм, кроме питательных веществ, поступают также вода, кислород, минеральные соли.
Поступившие в клетки органические вещества (или синтезированные в ходе фотосинтеза) расщепляются на строительные блоки - мономеры и направляются во все клетки организма. Часть молекул этих веществ расходуется на синтез специфических органических веществ, присущих данному организму. В клетках синтезируются белки, липиды, углеводы, нуклеиновые кислоты и другие вещества, которые выполняют различные функции (строительную, каталитическую, регуляторную, защитную и т.д.).
Другая часть низкомолекулярных органических соединений, поступивших в клетки, идет на образование АТФ, в молекулах которой заключена энергия, предназначенная непосредственно для выполнения работы. Энергия необходима для синтеза всех специфических веществ организма, поддержания его высокоупорядоченной организации, активного транспорта веществ внутри клеток, из одних клеток в другие, из одной части организма в другую, для передачи нервных импульсов, передвижения организмов, поддержания постоянной температуры тела (у птиц и млекопитающих) и для других целей.
В ходе превращения веществ в клетках образуются конечные продукты обмена, которые могут быть токсичными для организма и выводятся из него (например, аммиак). Таким образом, все живые организмы постоянно потребляют из окружающей среды определенные вещества, преобразуют их и выделяют в среду конечные продукты.
Совокупность химических реакций, происходящих в организме, называется обменом веществ или метаболизмом. В зависимости от общей направленности процессов выделяют катаболизм и анаболизм.
Катаболизм (диссимиляция) - совокупность реакций, приводящих к образованию простых соединений из более сложных. К катаболическим относят, например, реакции гидролиза полимеров до мономеров и расщепление последних до углекислого газа, воды, аммиака, т.е. реакции энергетического обмена, в ходе которого происходит окисление органических веществ и синтез АТФ.
Анаболизм (ассимиляция) - совокупность реакций синтеза сложных органических веществ из более простых. Сюда можно отнести, например, фиксацию азота и биосинтез белка, синтез углеводов из углекислого газа и воды в ходе фотосинтеза, синтез полисахаридов, липидов, нуклеотидов, ДНК, РНК и других веществ.
Синтез веществ в клетках живых организмов часто обозначают понятием пластический обмен, а расщепление веществ и их окисление, сопровождающееся синтезом АТФ, - энергетическим обменом. Оба вида обмена составляют основу жизнедеятельности любой клетки, а следовательно, и любого организма и тесно связаны между собой. С одной стороны, все реакции пластического обмена нуждаются в затрате энергии. С другой стороны, для осуществления реакций энергетического обмена необходим постоянный синтез ферментов, так как продолжительность их жизни невелика. Кроме того, вещества, используемые для дыхания, образуются в ходе пластического обмена (например, в процессе фотосинтеза).
Фотоси́нтез - процесс образования органического вещества из углекислого газа и воды на свету при участии фотосинтетических пигментов (хлорофилл у растений, бактериохлорофилл и бактериородопсин у бактерий). В современной физиологии растений под фотосинтезом чаще понимается фотоавтотрофная функция - совокупность процессов поглощения, превращения и использования энергии квантов света в различных эндэргонических реакциях, в том числе превращения углекислого газа в органические вещества.
Фотосинтез является основным источником биологической энергии, фотосинтезирующие автотрофы используют её для синтеза органических веществ из неорганических, гетеротрофы существуют за счёт энергии, запасенной автотрофами в виде химических связей, высвобождая её в процессах дыхания и брожения. Энергия, получаемая человечеством при сжигании ископаемого топлива (уголь, нефть, природный газ, торф), также является запасённой в процессе фотосинтеза.
Фотосинтез является главным входом неорганического углерода в биологический цикл. Весь свободный кислород атмосферы - биогенного происхождения и является побочным продуктом фотосинтеза. Формирование окислительной атмосферы (кислородная катастрофа) полностью изменило состояние земной поверхности, сделало возможным появление дыхания, а в дальнейшем, после образования озонового слоя, позволило жизни выйти на сушу.
Хемосинтез - способ автотрофного питания, при котором источником энергии для синтеза органических веществ из CO2 служат реакции окисления неорганических соединений. Подобный вариант получения энергии используется только бактериями. Явление хемосинтеза было открыто в 1887 году русским учёным С.Н. Виноградским.
Необходимо отметить, что выделяющаяся в реакциях окисления неогранических соединений энергия не может быть непосредственно использована в процессах ассимилияции. Сначала эта энергия переводится в энергию макроэнергетических связей АТФ и только затем тратится на синтез органических соединений.
Хемолитоавтотрофные организмы:
Железобактерии (Geobacter, Gallionella) окисляют двухвалентное железо до трёхвалентного.
Серобактерии (Desulfuromonas, Desulfobacter, Beggiatoa) окисляют сероводород до молекулярной серы или до солей серной кислоты.
Нитрифицирующие бактерии (Nitrobacteraceae, Nitrosomonas, Nitrosococcus) окисляют аммиак, образующийся в процессе гниения органических веществ, до азотистой и азотной кислот, которые, взаимодействуя с почвенными минералами, образуют нитриты и нитраты.



