Что было установлено по результатам опытов резерфорда. Опыт Резерфорда • Джеймс Трефил, энциклопедия «Двести законов мироздания. В чем логическая непоследовательность планетарной модели атома
РЕЗЕРФОРД Эрнст (1871-1937), английский физик, один из создателей учения о радиоактивности и строении атома, основатель научной школы, иностранный член-корреспондент РАН (1922) и почетный член АН СССР (1925). Директор Кавендишской лаборатории (с 1919). Открыл (1899) альфа- и бета-лучи и установил их природу. Создал (1903, совместно с Ф. Содди) теорию радиоактивности. Предложил (1911) планетарную модель атома. Осуществил (1919) первую искусственную ядерную реакцию. Предсказал (1921) существование нейтрона. Нобелевская премия (1908).
С трубой Гейгера-Мюллера, которая была основана на другом принципе, и особенно с трубами Уинна-Уильямса и связанной с ними электроникой, исследователи в лаборатории смогли считать частицы намного более высокими, чем с сцинтилляциями и другими преимуществами. Резерфорд признал ценность своих экспериментаторов контакта с физиками-теоретиками и поощрял их присутствие в лаборатории. Некоторые из них, такие как Гамов, приезжали в качестве посетителей на определенный период времени. Кембриджские теоретики, однако, были административными средствами в математическом отделе и были несколько изолированы от Кавендиша.
Опыт Резерфорда (1906 г.) по рассеянию быстрых заряженных частиц при прохождении через тонкие слои вещества позволили исследовать внутреннюю структуру атомов. В этих опытах для зондирования атомов использовались α – частица – полностью ионизированные атомы гелия, - возникающие при радиоактивном распаде радия и некоторых других элементов. Этими частицами Резерфорд бомбардировал атомы тяжелых металлов.
Заметным исключением был Ральф Фаулер, зять Резерфорда, чьи советы охотно искали в течение почти двух десятилетий, которые Резерфорд направил в лабораторию. Чадвик предпринял несколько попыток обнаружить нейтральную частицу, но никто не добился успеха, пока не узнал о экспериментах Жолио-Кюри в Париже, в которых, по их словам, испускались чрезвычайно проникающие гамма-лучи. Как он подозревал, Чадвик обнаружил, что лучи не были гаммами, а нейтронами: и вскоре после этого Норман Перо, также у Кавендиша, показал, что нейтроны способны вызвать ядерные распада.
Резерфорду было известно, что атомы состоят из легких отрицательно заряженных частиц – электронов и тяжелой положительно заряженной частицы. Основная цель опытов – выяснить, как распределен положительный заряд внутри атома. Рассеяние α – частиц (то есть изменение направления движения) может вызвать только положительно заряженная часть атома.
Даже к началу второго периода Резерфорда в Кембридже он был общественным деятелем. Он все чаще сталкивался с внешними вызовами своего времени, у него все меньше возможностей для его собственных исследований и для того, чтобы быть в курсе работы своих учеников. Тем не менее, с традицией энтузиазма в отношении исследований, которые он установил ранее, его еще частые раунды, чтобы «выгнать» своих «мальчиков» и неоценимую помощь Чадвика, результат лаборатории оставался гораздо более чем респектабельным.
Было много других публичных лекций, к которым была приложена большая честь, например, его президентское обращение к Британской ассоциации содействия развитию науки на обеих постах включало в себя множество публичных выступлений, таких как открытие конференций и новых лабораторий, помимо административных и политических -простая работа. Хотя либерально мыслящие, Резерфорд обычно побочные политические вопросы.
Опыты показали, что некоторая часть α – частиц рассеивается на большие углы, близки к 180˚, то есть отбрасывается назад. Это возможно только в том случае, если положительный заряд атома сосредоточен в очень малой центральной части атома – атомном ядре. В ядре сосредоточена также почти вся масса атома.
Оказалось, что ядра различных атомов имеют диаметры порядка 10 -14 – 10 -15 см, в то время как размер самого атома ≈10 -8 см, то есть в 10 4 – 10 5 раз превышает размер ядра.
В работе, которая может быть охарактеризована как радиоактивность в Макгилле, атомная физика в Манчестере и ядерная физика в Кембридже, Резерфорд, больше, чем любой другой, сформировали теперь взгляды, касающиеся природы материи. Следует ожидать, что к такому человеку придут многочисленные почести, названные величайшим физиком-экспериментатором того времени, и часто по сравнению с Фарадеем.
В Библиотеке Кембриджского университета сохранилось около двух десятков коробок корреспонденции Резерфорда и разных статей. Книги Резерфорда - Радио-деятельность; Радиоактивные трансформации; Радиоактивные вещества и их излучения; Излучения от радиоактивных веществ, написанные Дж. Эллисом; и Новая Алхимия. Часть его переписки воспроизводится в Лоуренсе Бадаше, ред. Резерфорд и Болтвуд, «Письма о радиоактивности». Бадаш также составил каталог переписки Резерфорда.
Таким образом, атом оказался «пустым».
На основании опытов по рассеянию α – частиц на ядрах атомов Резерфорд пришел к планетарной модели атома. Согласно этой модели атом состоит из небольшого положительно заряженного ядра и обращающихся вокруг него электронов.
С точки зрения классической физики такой атом должен быть неустойчив, так как электроны движущиеся по орбитам с ускорением, должны непрерывно излучать электромагнитную энергию.
Шир, Резерфорд и ядерный атом; и, особенно ценный для личной информации, Марк Олифант, Резерфорд, Воспоминания о днях Кембриджа. Капицы, изд. Резерфорд-ученый и учитель, о сотнелетия его рождения, который находится на русском языке. Физическое здание Макдональда. С., у великих современников, стр. 359-. Быть Личным Воспоминаниям помощника лорда Резерфорда. Здесь опубликовано в первый раз. Британский физик Эрнест Резерфорд, 1-й барон Резерфорд из Нельсона, обнаружил трансмутацию элементов, атом атома и множество других явлений, чтобы стать самым выдающимся физиком-экспериментатором своего времени.
Дальнейшее развитие представлений о строении атомов было сделано Н. Бором (1913 г.) на основе квантовых представлений.
Данный опыт возможно провести при помощи специального прибора, чертеж которого изображен на рисунке 1. Этот прибор представляет собой свинцовую коробочку с полным вакуумом внутри её и микроскопом.
В поисках экспериментального физика, который можно сравнить с лордом Резерфордом, естественно думать о Майкле Фарадее. Как и Фарадей, Резерфорд инстинктивно знал, какие эксперименты дадут самые глубокие сведения о деятельности природы; в отличие от Фарадея, Резерфорд создал школу последователей, обучая большое количество физиков-исследователей. Один из его коллег заметил, что Резерфорд всегда оказывался на «гребне волны». Большинство физиков согласились бы, что это было в значительной степени. Его отец, шотландец, был колесником, фермером, лесорубом и крупным производителем льна.
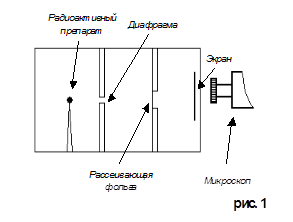
Рассеяние (изменение направления движения) α – частиц может вызвать только положительно заряженная часть атома. Таким образом, по рассеянию α – частиц можно определить характер распределения положительного заряда и массы внутри атома. Схема опытов Резерфорда показана на рисунке 1. Испускаемый радиоактивным препаратом пучок α – частиц выделялся диафрагмой и после этого падал на тонкую фольгу из исследуемого материала (в данном случае это золото). После рассеяния α – частицы попадали на экран, покрытый сернистым цинком. Столкновение каждой частицы с экраном сопровождалось вспышкой света (сцинтилляцией), которую можно было наблюдать в микроскоп.
Резерфорд посещал колледж Нельсона, среднюю школу, а затем учился в Кентерберийском колледже в Крайстчерче, получив степень бакалавра. В следующем году он получил степень магистра по специальности «математика и физика». Интерес Резерфорда к оригинальным исследованиям побудил его остаться в Кентербери еще на год. Используя довольно примитивные исследовательские объекты, доступные ему, он доказал, что железо может быть намагничено быстрым осциллирующим электрическим полем, создаваемым во время разряда катушки Тесла.
Томсон в лаборатории Кавендиша. Он улучшил свои ранние приборы и вскоре передал и получил электромагнитные сигналы до расстояния в 2 мили, что было большим достижением в те дни. Томсон попросил Резерфорда помочь ему в его собственных исследованиях по индуцированной рентгеновским излучением электричеством через газы. Через год эти исследования привели Томсона к его открытию электрона.
При хорошем вакууме внутри прибора в отсутствие фольги на экране возникала полоска света, состоящая из сцинтилляций, вызванных тонким пучком α – частиц. Но когда на пути пучка помещалась фольга, α – частицы из-за рассеяния распределялись на большей площади экрана.
В нашем опыте нужно исследовать α – частицу, которая направлена на ядро золота при составлении угла 180° (рис. 2) и проследить за реакцией α – частицы, т.е. на какое минимальное расстояние α – частица приблизится к ядру золота (рис. 3).
Резерфорд вскоре определил, что лучи урана способны ионизировать газы. Он также обнаружил что-то новое, а именно, что уран выделяет два разных типа излучения: высоко ионизирующее излучение с низкой проникающей способностью, которое он назвал альфа-излучение, и гораздо более низкое ионизирующее излучение с высокой проникающей способностью, которое он назвал бета-излучением. За эти годы его научные горизонты значительно расширились; и его уверенность значительно возросла из-за открытого признания Томсоном его исключительных способностей.
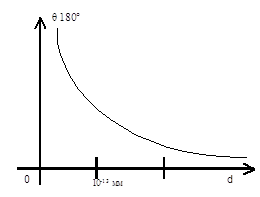 Рис. 2
Рис. 2
 Рис.3
Рис.3
V 0 =1,6*10 7 м / с – начальная скорость
Какое минимальное расстояние r min между α – частицей и ядром удастся реализовать в данном эксперименте? (Рис. 4)
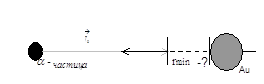 Рис.4
Рис.4
Первым профессором Резерфорда была профессора Макдональда по физике в Университете Макгилла в Монреале. Что касается исследований, Резерфорд точно знал область, которую он хотел изучить: радиоактивность. Оуэнс, молодой коллега по электротехнике, подготовил образец оксида тория для изучения ионизирующей способности излучений тория. Оуэнс, как ни странно, обнаружил, что создаваемая ими ионизация, по-видимому, зависела от наличия или отсутствия проходящих воздушных потоков оксид тория. Ничего подобного никогда не наблюдалось с ураном.
Именно эта тайна Оуэнс, отправляясь в отпуск, ушла, чтобы разрешить Резерфорду. Резерфорд разработал серию мастерских экспериментов, из которых он пришел к выводу, что торий каким-то образом вырабатывает газ, который он назвал «ториевой эманацией». Именно этот газ переносил воздушные потоки Оуэнса, тем самым влияя на регистрируемую ионизацию. Резерфорд также обнаружил, что всякая ториевая эманация, полученная вскоре, исчезла на его глазах! Пропуская некоторую ториевую эманацию через длинную трубку с постоянной скоростью, Резерфорд обнаружил что половина суммы, присутствующей в любой момент времени, исчезает примерно каждую минуту - ее «период полураспада».
В нашем эксперименте α – частица представлена как атом
![]() m нейтр кг
m нейтр кг
Z=2 – протонов
N = Au – Z = 4 – 2 = 2 нейтрона
![]()
Z=79 – число протонов
N = Au – Z = 196 – 79 =117 (нейтронов)
![]()
Дальнейшие исследования показали, что давление или другие внешние условия не влияли на эти периоды полураспада. Кроме того, «деятельность» веществ как функция времени, затухающих экспоненциально, что Резерфорд осознал, возможно только в том случае, если активность была прямо пропорциональна количеству «ионов», присутствующих в любой момент времени. Вместе они решили изолировать источники радиоактивности тория методами химического разделения.
Предмет после пункта теперь встал на свои места. Содди, превратившись из тория в уран, обнаружил, что он распался на новый радиоактивный элемент «уран Х». Затем Резерфорд понял, что каждый радиоактивный переход сопровождается мгновенным испусканием одной альфа - или бета-частицы. Резерфорд также доказал простым подсчетом, что при радиоактивных превращениях высвобождаются огромные количества энергии, которые, по его мнению, могут быть получены только из внутреннего атомного источника.
![]()
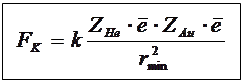
![]()
![]() Кл 2 /H ∙м 2 – электрическая постоянная
Кл 2 /H ∙м 2 – электрическая постоянная
![]() m 2 =6,6∙10 -27 кг
m 2 =6,6∙10 -27 кг
Хотя некоторые ссылки все еще отсутствовали, революционная теория радиоактивных преобразований Резерфорда была по существу завершена ранним В этой лекции, одной из классиков в физике литературы, он представил полную математическую формулировку своей теории, определил четыре радиоактивных ряда - урана, тория, актиния и радия, и установил принцип, хотя и молчаливо, что любой радиоактивный элемент может быть однозначно идентифицирован по периоду полураспада.
Резерфорд также прочитал лекцию в Королевском институте, в которой он подробно остановился на важном следствии своей теории - ее последствиях для возраста Земли. Он понял, что свинец, стабильный элемент, является конечным продуктом каждого радиоактивного ряда. Это означало, что, определяя относительные количества, например, урана и свинца в образце породы, можно рассчитать возраст, который является основой метода радиоактивного датирования.
Z He ∙2∙ - заряд ядра (He) Z Au ∙- заряд ядра (Au)
Заряд α-частицы равен 2 элементарным.
Ответ: r min =4,3·10 -14 м
Вывод: При этом опыте удалось выяснить, что a-частица смогла приблизится к ядру атома на минимальное расстояние, которое составило r min =4,3·10 -14 м и возвратится обратно, по той же траектории по которой она начинала движение.
Исследователи Резерфорда привлекли к Макгиллу нескольких ученых. Его деятельность там - преподавание, экспериментирование, написание его знаменитой книги «Радиоактивность» - были потрясающими. Однако он отказался разочаровать Нобелевский комитет и назвал свою Нобелевскую лекцию Химическая природа Альфа-частицы от радиоактивных веществ.
Ядерный атом и искусственные трансмутации
Кажется, что Резерфорд наслаждался преподаванием в Манчестере больше, чем в Макгилле. Это довольно освежает после критического отношения канадских студентов. Одним из первых вопросов, которые он хотел решить, была природа альфа-частиц. Он разработал очень простую схему захвата альфа-частиц из очищенной эманации радия в стеклянном корпусе. Там альфа-частицы приобрели свободные электроны и образовали газ, спектроскопический анализ которого оказался гелием. Эта работа приобрела гораздо более широкое значение в результате другого наблюдения, а именно, что альфа-частицы могут рассеиваться различными веществами.
Когда этот же опыт Резерфорд проделал в первые, при таком расположении a-частицы по отношению к углу составляющему 180° он удивленно сказал: «Это почти столь же невероятно, как если бы вы выстрелили 15-дюймовым снарядом в кусок тонкой бумаги, а снаряд возвратился бы к вам и нанес вам удар».
И в правду, это не вероятно, дело в том, что проводя этот опыт на меньших углах, то а - частица обязательно отскочит в сторону, подобно тому как камушек несколько десятков граммов при столкновении с автомобилем не в состоянии заметно изменить его скорость (рис. 5). Так как их масса примерно в 8000 раз больше массы электрона, а положительный заряд равен по модулю удвоенному заряду электрона. Это не что иное, как полностью ионизированные атомы гелия. Скорость α – частиц очень велика: она составляет 1 / 15 скорости света. Следовательно, электроны вследствие своей малой массы не могут заметно изменить траекторию α – частицы.
Прошло два года до того, как Резерфорд достиг проницательности, необходимой для удовлетворительного объяснения экспериментов Гейгера и Марсдена. Он должен был понять, что альфа-частица не имеет атомных размеров, но ее можно считать точечным зарядом в теоретических расчетах рассеяния и что число электронов на атом относительно невелико - по одному и тому же порядку величины, численно говоря, как атомный вес атома. Ядерный атом родился.
Однако никто не заметил нового прибытия. Какова бы ни была новизна современных физиков к работе Резерфорда, похоже, была связана с его теорией рассеяния, а не с его моделью атома, которая была лишь одной из многих моделей, представленных в литературе. Только тогда, например, понятие изотопов становятся общепризнанными.
![]() Рис. 5
Рис. 5
Существуют нейтральные микрообъекты (например, фотон, нейтрино, нейтрон). Электрический заряд сложного микрообъекта равен алгебраической сумме зарядов составляющих его частиц. 4. Идея корпускулярно-волнового дуализма как методологический принцип Классическая физика знакомит с двумя видами движения -корпускулярным и волновым. Для первого характерны локализация объекта в пространстве и...
Телепередача из печени и др. Любопытные эффекты и остроумные решения: радиоактивность человека, радиоактивный сыр, восстановление пропавших изображений на фотографиях, автографы невидимок. Методы поиска и исследований в преподавании физики Введение От мифов к простым фактам. Потребность в познании мира в начале привела к попыткам объяснить мир сразу в целом, немедленно получить ответы на...
Атом состоит из компактного и массивного положительно заряженного ядра и отрицательно заряженных легких электронов вокруг него.
Эрнест Резерфорд — уникальный ученый в том плане, что свои главные открытия он сделал уже после получения Нобелевской премии. В 1911 году ему удался эксперимент, который не только позволил ученым заглянуть вглубь атома и получить представление о его строении, но и стал образцом изящества и глубины замысла.
Используя естественный источник радиоактивного излучения, Резерфорд построил пушку, дававшую направленный и сфокусированный поток частиц. Пушка представляла собой свинцовый ящик с узкой прорезью, внутрь которого был помещен радиоактивный материал. Благодаря этому частицы (в данном случае альфа-частицы, состоящие из двух протонов и двух нейтронов), испускаемые радиоактивным веществом во всех направлениях, кроме одного, поглощались свинцовым экраном, и лишь через прорезь вылетал направленный пучок альфа-частиц. Далее на пути пучка стояло еще несколько свинцовых экранов с узкими прорезями, отсекавших частицы, отклоняющиеся от строго заданного направления. В результате к мишени подлетал идеально сфокусированный пучок альфа-частиц, а сама мишень представляла собой тончайший лист золотой фольги. В нее-то и ударял альфа-луч. После столкновения с атомами фольги альфа-частицы продолжали свой путь и попадали на люминесцентный экран, установленный позади мишени, на котором при попадании на него альфа-частиц регистрировались вспышки. По ним экспериментатор мог судить, в каком количестве и насколько альфа-частицы отклоняются от направления прямолинейного движения в результате столкновений с атомами фольги.
Эксперименты подобного рода проводились и раньше. Основная их идея состояла в том, чтобы по углам отклонения частиц накопить достаточно информации, по которой можно было бы сказать что-либо определенное о строении атома. В начале ХХ века ученые уже знали, что атом содержит отрицательно заряженные электроны. Однако преобладало представление, что атом представляет собой что-то похожее на положительно заряженную тонкую сетку, заполненную отрицательно заряженными электронами-изюминами, — модель так и называлась «модель сетки с изюмом». По результатам подобных опытов ученым удалось узнать некоторые свойства атомов — в частности, оценить порядок их геометрических размеров.
Резерфорд, однако, заметил, что никто из его предшественников даже не пробовал проверить экспериментально, не отклоняются ли некоторые альфа-частицы под очень большими углами. Модель сетки с изюмом просто не допускала существования в атоме столь плотных и тяжелых элементов структуры, что они могли бы отклонять быстрые альфа-частицы на значительные углы, поэтому никто и не озабочивался тем, чтобы проверить такую возможность. Резерфорд попросил одного из своих студентов переоборудовать установку таким образом, чтобы можно было наблюдать рассеяние альфа-частиц под большими углами отклонения, — просто для очистки совести, чтобы окончательно исключить такую возможность. В качестве детектора использовался экран с покрытием из сульфида натрия — материала, дающего флуоресцентную вспышку при попадании в него альфа-частицы. Каково же было удивление не только студента, непосредственно проводившего эксперимент, но и самого Резерфорда, когда выяснилось, что некоторые частицы отклоняются на углы вплоть до 180°!
В рамках устоявшейся модели атома полученный результат не мог быть истолкован: в сетке с изюмом попросту нет ничего такого, что могло бы отразить мощную, быструю и тяжелую альфа-частицу. Резерфорд вынужден был заключить, что в атоме большая часть массы сосредоточена в невероятно плотном веществе, расположенном в центре атома. А вся остальная часть атома оказывалась на много порядков менее плотной, нежели это представлялось раньше. Из поведения рассеянных альфа-частиц вытекало также, что в этих сверхплотных центрах атома, которые Резерфорд назвал ядрами , сосредоточен также и весь положительный электрический заряд атома, поскольку только силами электрического отталкивания может быть обусловлено рассеяние частиц под углами больше 90°.
Годы спустя Резерфорд любил приводить по поводу своего открытия такую аналогию. В одной южноафриканской стране таможню предупредили, что в страну собираются провезти крупную партию контрабандного оружия для повстанцев, и оружие будет спрятано в тюках хлопка. И вот перед таможенником после разгрузки оказывается целый склад, забитый тюками с хлопком. Как ему определить, в каких именно тюках спрятаны винтовки? Таможенник решил задачу просто: он стал стрелять по тюкам, и, если пули рикошетили от какого-либо тюка, он по этому признаку и выявлял тюки с контрабандным оружием. Так и Резерфорд, увидев, как альфа-частицы рикошетируют от золотой фольги, понял, что внутри атома скрыта гораздо более плотная структура, чем предполагалось.
Картина атома, нарисованная Резерфордом по результатам опыта, нам сегодня хорошо знакома. Атом состоит из сверхплотного, компактного ядра, несущего на себе положительный заряд, и отрицательно заряженных легких электронов вокруг него. Позже ученые подвели под эту картину надежную теоретическую базу (см. Атом Бора), но началось всё с простого эксперимента с маленьким образцом радиоактивного материала и куском золотой фольги.
См. также:
Ernest Rutherford, First Baron Rutherford of Nelson, 1871-1937
Новозеландский физик. Родился в Нельсоне, в семье фермера-ремесленника. Выиграл стипендию для получения образования в Кембриджском университете в Англии. После его окончания получил назначение в канадский университет Мак-Гилл (McGill University), где совместно с Фредериком Содди (Frederick Soddy, 1877-1966) установил основные закономерности явления радиоактивности, за что в 1908 году был удостоен Нобелевской премии по химии. Вскоре ученый перебрался в Манчестерский университет, где под его руководством Ханс Гейгер (Hans Geiger, 1882-1945) изобрел свой знаменитый счетчик Гейгера, занялся исследованиями строения атома и в 1911 году открыл существование атомного ядра. В годы Первой мировой войны занимался разработкой сонаров (акустических радаров) для обнаружения подводных лодок противника. В 1919 году был назначен профессором физики и директором Кавендишской лаборатории Кембриджского университета и в том же году открыл распад ядра в результате бомбардировки тяжелыми частицами высоких энергий. На этом посту Резерфорд оставался до конца жизни, одновременно являясь на протяжении многих лет президентом Королевского научного общества. Похоронен в Вестминстерском аббатстве рядом с Ньютоном, Дарвином и Фарадеем.



