Мир прекрасен
АТОМ , мельчайшая частица вещества, которая может вступать в химические реакции. У каждого вещества имеется характерный только для него набор атомов. В свое время считалось, что атом неделим, однако, он состоит из положительно заряженного ЯДРА, вокруг которого вращаются отрицательно заряженные электроны. Ядро (наличие которого установил в 1911 г. Эрнст РЕЗЕРФОРД) состоит из плотно упакованных протонов и нейтронов. Оно занимает внутри атома лишь малую часть пространства, однако, на него приходится почти вся масса атома. В 1913 г. Нильс БОР предположил, что электроны движутся по фиксированным орбитам. С тех пор исследования по КВАНТОВОЙ МЕХАНИКЕ привели к новому пониманию орбит: согласно ПРИНЦИПУ НЕОПРЕДЕЛЕННОСТИ Гейзенберга точную позицию и МОМЕНТ движения субатомной частицы одновременно узнать невозможно. Число электронов в атоме и их расположение определяют химические свойства элемента. При добавлении или отнятии одного или более электрона возникает ион.
Масса атома зависит от размера ядра. На него приходится максимальная доля веса атома, поскольку электроны ничего не весят. Например, атом урана - самый тяжелый из встречающихся в природе атомов У него 146 нейтронов, 92 протона и 92 электрона. С другой стороны, самым легким является атом водорода, у которого 1 протон и электрон. Однако атом урана, хотя и тяжелее атома водорода в 230 раз, по размерам превышает его лишь втрое. Вес атома выражается в единицах атомной массы и обозначается как u. Атомы состоят из еще более мелких частиц, назы-Улаемых субатомными (элементарными) частицами. Основными являются протоны (положительно заряженные), нейтроны (электрически нейтральные) и >лсктроны (отрицательно "заряженные). Скопления нроюнон и нейтронов обра зуют Ядро в центре атомом всех >лсмстон (за исключением водорода, у которого юлько один протон). " Электроны «крутятся» вокру! ядра на некотором расстоянии от него, соразмерно ра (мерам атома. |{сли, например, ядро атома гелия было бы размером с теннисный мячик, то электроны находились бы на расстоянии 6 км от него. Существует 112 различных типов атомов, столько же, сколько элементов н периодической таблице. Атомы элементов различаются по атомному номеру и атомной массе. ЯДРО АТОМА Масса атома со дается в основном за счет относительно плотного ядра. I (ротоны и нейтроны имеют массу в примерно 1К4() раз большую, чем электроны. Поскольку прогоны заряжены положительно, а нейтроны - нейтральны, ядро атома всегда заряжено положительно. 11оскольку противоположные заряды взаимно притягиваются, ядро удерживает электроны на их орбитах. Прогоны и нейтроны состоят из еще более мелких шсмппарних частиц, кварков. ЭЛЕКТРОНЫ Чих1"ю >к-к фоном в атоме определяет его химические гнонстиа H ошичис от планет Солнечной системы, немропы крутятся вокруг ядра случайным образом, oiMiiMi ни фиксированном расстоянии от ядра, обра-IVH "оСюлочки». Чем большей энергией обладает элек-ipon. li"M дальше он может удалиться, преодолевая притяжение положительно заряженного ядра. В нейтральном атоме положительный заряд электронов уравновешивает положительный заряд протонов ядра. 11оэтому удаление или добавление одного электрона в агоме приводит к появлению заряженного иона. Электронные оболочки расположены на фиксированных расстояниях от ядра в зависимости от уровня их энергии. Каждую оболочку нумеруют, считая от ядра. Н агоме не бывает более семи оболочек, и каждая из них может содержать только определенное число электронов. Если имеется достаточное количество энергии, электрон может перескочить с одной оболочки на другую, более высокую. Когда он снова попадает на более низкую оболочку, он испускает излучение в виде фотона. Электрон принадлежит к классу частиц, называемых лептонами, его античастица называется позитроном.
ЦЕПНАЯ ЯДЕРНАЯ РЕАКЦИЯ. При ядерном взрыве, например, аюмнои оомбы, нейтрон ударяет по ядру урана 23Ь (то есть ядру с общим количес твом протонов и нейтронов, равным?35). При:ном ней трон поглощается, и создайся уран 236 Он очень нестоек и расщепляется на два меньших ядра, при чем выделяется огромное количество энергий и несколько нейтронов Каж дыи из этих нейтронов может, в свою очередь, ударить по еще одному ядру урана Если созданы гак называемые критические условия (количество урана-235 превышает кригическую массу), тогда число соударений нейтронов пудет достаточным, чтобы реакция развивалась с молниеносной скоростью, т.е. происходит цепная реакция. В ядерном реакторе гепло, выделяемое при эюм процессе, используется для нагрева пара, который приводит в дви жение турбогенератор, вырабатывающий электричество.
Научно-технический энциклопедический словарь .
Молекула (новолат. molecula, уменьшит. от лат. moles-масса), микрочастица, образованная из двух или большего числа атомов и способная к самостоятельному существованию. Имеет постоянный состав (качественный и количественный) входящих в нее атомных ядер и фиксированное число электронов и обладает совокупностью свойств, позволяющих отличать одну молекулу от других, в том числе от молекул того же состава. Молекула, как система, состоящая из взаимодействующих электронов и ядер, может находиться в различных состояниях и переходить из одного состояния в другое вынужденно (под влиянием внешних воздействий) или самопроизвольно. Для всех молекул данного вида характерна некоторая совокупность состояний, которая может служить для идентификации молекул. Как самостоятельное образование молекула обладает в каждом состоянии определенным набором физических свойств, эти свойства в той или иной степени сохраняются при переходе от молекул к состоящему из них веществу и определяют свойства этого вещества. При химических превращениях молекула одного вещества обмениваются атомами с молекулами другого вещества, распадаются на молекулы с меньшим числом атомов, а также вступают в химические реакции других типов. Поэтому химия изучает вещества и их превращения в неразрывной связи со строением и состоянием молекул
Обычно молекулой называют электрически нейтральную частицу; если молекула несет электрический заряд (положительный или отрицательный), то говорят о молекулярных ионах (катионах или анионах соответственно). В веществе положительные ионы всегда сосуществуют вместе с отрицательными. Молекулы, находящиеся в состояниях с мультиплетностью, отличной от единицы (как правило, в дублетных состояниях), называют радикалами. Свободные радикалы в обычных условиях, как правило, не могут существовать длительное время. Известны, однако, свободные радикалы сравнительно сложного строения, которые являются достаточно стабильными и могут существовать при обычных условиях.
По числу входящих в молекулу атомных ядер различают молекулы двухатомные, трехатомные и т.д. Если число атомовв молекуле превосходит сотни и тысячи, молекула называется макромолекулой. Сумма масс всех атомов, входящих в состав молекулы, рассматривается как молекулярная масса (смотри также Молекулярная масса полимера. Молекулярно-массовое распределение). По величине молекулярной массы все вещества условно делят на низко- и высокомолекулярные.
А́том (от др.-греч. ἄτομος - неделимый) - частица вещества микроскопических размеров и массы, наименьшая часть химического элемента, являющаяся носителем его свойств.
Представление об атомах как неделимых мельчайших частицах вещества возникло еще в античные времена, но только в XVIII веке трудами А. Лавуазье, М. В. Ломоносова и других ученых была доказана реальность существования атомов.
Общая характеристика строения атома. Атом состоит из положительно заряженного ядра, окруженного облаком отрицательно заряженныхэлектронов. Размеры атома в целом определяются размерами его электронного облака и велики по сравнению с размерами _ядра атома (линейные размеры атома ~ 10~ 8 см, его ядра ~ 10" -10" 13 см). Электронное облако атома не имеет строго определенных границ, поэтому размеры атома в значит. степени условны и зависят от способов их определения (см. Атомные радиусы). Ядро атома состоит из Z протонов и N нейтронов, удерживаемых ядерными силами (см. Ядро атомное). Положит. заряд протона и отрицат. заряд электрона одинаковы по абс. величине и равны е= 1,60*10 -19 Кл; нейтрон не обладает элек-трич. зарядом. Заряд ядра +Ze - осн. характеристика атома, обусловливающая его принадлежность к определенному хим. элементу. Порядковый номер элемента в периодич. системе Менделеева (атомный номер) равен числу протонов в ядре.
В электрически нейтральном атоме число электронов в облаке равно числу протонов в ядре. Однако при определенных условиях он может терять или присоединять электроны, превращаясь соотв. в положит. или отрицат. ион, напр. Li + , Li 2+ или О - , О 2- . Говоря об атомах определенного элемента, подразумевают как нейтральные атомы, так и ионы этого элемента.
Строение атома и свойства веществ . Хим. св-ва определяются строением внеш. электронных оболочек атомов, в к-рых электроны связаны сравнительно слабо (энергии связи от неск. эВ до неск. десятков эВ). Строение внеш. оболочек атомов хим. элементов одной группы (или подгруппы) периодич. системы аналогично, что и обусловливает сходство хим. св-в этих элементов.(1) При увеличении числа электронов в заполняющейся оболочке их энергия связи, как правило, увеличивается; наиб. энергией связи обладают электроны в замкнутой оболочке. Поэтому атомы с одним или неск. электронами в частично заполненной внеш. оболочке отдают их в хим. р-циях. Атомы, к-рым не хватает одного или неск. электронов для образования замкнутой внеш. оболочки, обычно принимают их. Атомы благородных газов, обладающие замкнутыми внеш. оболочками, при обычных условиях не вступают в хим. р-ции.
Строение внутр. оболочек атомов, электроны которых связаны гораздо прочнее (энергия связи 10 2 -10 4 эВ), проявляется лишь при взаимод. атомов с быстрыми частицами и фотонами высоких энергий. Такие взаимод. определяют характер рентгеновских спектров и рассеяние частиц (электронов,нейтронов) на атомах (см. Дифракционные методы). Масса атома определяет такие его физ. св-ва, как импульс, кинетич. энергия. От механических и связанных с ними магн. и электрич. моментов ядра атома зависят нек-рые тонкие физ. эффекты (ЯМР, ЯКР, сверхтонкая структура спектральных линий, см Спектроскопия).
1сноска: Электро́нво́льт (редко электроновольт ; русское обозначение: эВ , международное: eV ) - внесистемная единица энергии, используемая в атомной и ядерной физике, в физике элементарных частиц и в близких и родственных областях науки (биофизике, физической химии, астрофизике и т. п.). В Российской Федерации электронвольт допущен к использованию в качестве внесистемной единицы без ограничения срока с областью применения.
Ядерная модель атома
В начале 20 века в результате изучения катодных лучей были обнаружены отрицательные частицы – электроны с зарядом 1,6 . 10‾ 19 Кл, массой 9,11 . 10‾ 31 кг, открыто рентгеновское электромагнитное излучение. Обобщив эти открытия, Дж.Томсон в 1897 году предложил свою модель атома – это положительно заряженная сфера, в которую вкраплены отрицательные электроны (подобно изюму в пудинге). Если эта модель верна, тогда металлическая фольга – это пленка положительного электричества, содержащая электроны и поток α- частиц должен легко проникать через нее, не меняя направление.
В 1909 г. сотрудники англ. ученого Э. Резерфорда это проверили. 1 из 100000 α - частиц при прохождении через золотую фольгу рассеивались на большие углы и даже поворачивали обратно. Анализируя результаты эксперимента, Резерфорд сделал вывод, что масса и заряд атома сконцентрированы в малой части объема, называемой ядром. Отклоняются те α - частицы, которые сталкиваются с ядрами. Большинство же α - частиц проходит через пространство между ядрами. Модель строения атома, предложенная Э. Резерфордом, напоминала солнечную систему. Ее называют планетарной моделью. Согласно ей, в центре атома находится положительное ядро, в котором сосредоточена вся масса атома. Вокруг ядра по круговым орбитам движутся электроны. Заряд ядра и число электронов одинаковы, т.е. атом нейтральная частица.
В 1913г. английский физик Мозли измерил длины волн рентгеновских лучей, испускаемых разными металлами в катодной трубке, и построил график зависимости обратного значения квадратного корня из длины волны рентгеновских лучей от порядкового номера элемента. Этот график (рис.1) показывает, что порядковый номер отражает какую-то важную характеристику элемента. Мозли предположил, что этой характеристикой является заряд ядра атома, и что он возрастает на единицу при переходе от одного элемента к следующему за ним по порядку. Он назвал порядковый номер атомным номером - Z .
Закон Мозли :
Корень квадратный из величины, обратной длине волны рентгеновских лучей, испускаемых атомами различных элементов, находится в линейной зависимости от порядкового номера элемента.
Это закон, связывающий частоту спектральных линий характеристического рентгеновского излучения атома химического элемента с его порядковым номером.
где - длина волны, а – постоянная величина, Z – порядковый номер элемента (заряд ядра).
Позже стало известно, что порядковый номер равен числу протонов в ядре. Таким образом, порядковый (атомный) номер равен заряду ядра и он же определяет наличие в нем протонов (положительных частиц). А так как атомы нейтральны, то число электронов в атоме должно быть равно числу протонов. Но массы атомов оказались больше суммарной массы протонов. Для объяснения избытка массы было высказано предположение о существовании нейтронов. Эти частицы должны были иметь ту же массу, что и протон, но нулевой заряд (1,675 . 10 - 27 кг). Нейтрон был открыт сотрудником Резерфорда Чедвигом в 1932 г. Было окончательно установлено, что атом состоит из ядра и электронов, а ядро – из протонов и нейтронов. Их сумму называютнуклонным числом или массовым - А .
А = Z + N ,
Z - число протонов, N - число нейтронов.
Атомы с различным числом протонов (Z ) и нейтронов (N ), но с одинаковым числом нуклонов А , называют изобарами . Например,
Изотопы – атомы с одинаковым числом протонов (Z ), но с разным числом нуклонов
Изотоны – атомы с одинаковым числом нейтронов (N )
Таким образом, дробные значения атомных масс в периодической системе объясняются наличием изотопов для одного и того же элемента.
А́томное ядро́ - центральная часть атома, в которой сосредоточена основная его масса (более 99,9 %). Ядро заряжено положительно, заряд ядра определяет химический элемент, к которому относят атом. Размеры ядер различных атомов составляют несколько фемтометров, что в более чем в 10 тысяч раз меньше размеров самого атома.
Спектра́льная ли́ния - особенность участка спектра, выражающаяся в локальном повышении (светлые, эмиссионные линии, спектральные максимумы) или понижении (тёмные линии, линии поглощения, спектральные минимумы) уровня сигнала.
Остаточной интенсивностью называют усиление/ослабление излучения в спектральной линии по сравнению с непрерывным спектром.
Функция, характеризующая зависимость остаточной интенсивности от частоты, называется профилем линии.
Рентге́новское излуче́ние - электромагнитные волны, энергия фотонов которых лежит на шкале электромагнитных волн между ультрафиолетовым излучением и гамма-излучением, что соответствует длинам волн от 10 −2 до 10 2 Å (от 10 −12 до 10 −8 м).
Фото́н (от др.-греч. φῶς, род. пад. φωτός, «свет») - элементарная частица, квант электромагнитного излучения (в узком смысле -света). Это безмассовая частица, способная существовать в вакууме только двигаясь со скоростью света.
Атом, как обособленная единица, построен из ядра, заряженного положительным и из электронов, несущих отрицательных заряд. Вот из чего состоит атом.
В его центре располагается ядро, которое образуют ещё более мелкие частицы - протоны и нейтроны. Относительно радиуса всего атома радиус ядра примерно в сто тысяч раз меньше. Плотность ядра чрезвычайно высока.
Стабильная ядра с положительным зарядом - это протон. Нейтрон - это элементарная частица, не обладающая электрическим зарядом, с массой, приблизительно равной массе протона. Масса ядра складывается, соответственно, из общей и нейтронов, совокупность которых в составе ядра сокращённо называют нуклоном. Эти нуклоны в ядре связаны уникальными Число протонов в атоме равно определённому количеству электронов в атомной оболочке и, как следствие, составляет основу для химических свойств атома.
Электрон как мельчайшая частица вещества несёт в себе элементарный отрицательный электрический постоянно вращаются вокруг ядра по определённым орбитам подобно вращению планет вокруг Солнца. Таким образом, на вопрос о том, из чего состоит атом, можно дать следующий ответ: из элементарных частиц с положительными, отрицательными и нейтральными зарядами.
Существует следующая закономерность: размер атома зависит от размера его электронной оболочки, или высоты орбиты. В рамках ответа на вопрос о том, из чего состоит атом, можно уточнить, что электроны способны как добавляться, так и удаляться из атома. Это обстоятельство превращает атом в положительный ион или, соответственно, в отрицательный. А сам процесс трансформации элементарной химической частицы называют ионизацией.
В сконцентрирован большой запас энергии, которая способна высвобождаться во время ядерных реакций. Такие реакции, как правило, возникают при столкновении атомных ядер с другими элементарными частицами или с ядрами иных химических элементов. В результате способны образовываться новые ядра. Например, реакция способна осуществить переход нейтрона в протон, при этом из ядра атома удаляется бета-частица, иначе - электрон.
Качественный переход в центре атома протона в нейтрон способен осуществляться двумя вариантами. В первом случае из ядра выходит частица с массой, которая равна массе электрона, однако с положительным зарядом, называющаяся позитроном (так называемый позитронный распад). Второй вариант предполагает захват ядром атома одного из ближайшей к нему электронов с К-орбиты (К-захват). Так химические элементы превращаются из одного в другой благодаря тому, из чего состоит атом.
Бывают такие состояния образовавшегося ядра, когда оно обладает избытком энергии, иначе говоря, оно находится в возбуждённом состоянии. В случае перехода в естественное состояние ядро выделяет чрезмерную энергию в виде порции электромагнитного излучения с очень малой длиной волны - так образуется гамма-излучение. Та энергия, что выделяется при осуществляемых ядерных реакциях, находит практическое применение в ряде отраслей науки и промышленности.
Атом - наименьшая частица химического элемента, сохраняющая все его химические свойства. Различным элементам соответствуют различные атомы.
Молекула - наименьшая частица вещества, обладающая его химическими свойствами.
Атомное ядро - центральная часть атома, состоящая из Z протонов и N нейтронов, в которой сосредоточена основная масса атомов.
Заряд ядра - положительный, по величине равен количеству протонов в ядре или электронов в нейтральном атоме и совпадает с порядковым номером элемента в периодической системе. Сумма протонов и нейтронов атомного ядра называется массовым числом A = Z + N.
Относительная атомная масса (A r ) - безразмерная величина, равная отношению средней массы атома элемента (с учетом процентного содержания изотопов в природе) к 1 / 12 массы атома 12 C.
А==![]()
Относительная молекулярная масса (M r )-это величина равная отношению средней массы молекулы к 1 а.е.м. численно равна сумме атома масс элементов, составляющих молекулу.
M г = m г / (1 / 12 m а (12 C))
M г (B 2 O 3) = 2 A r (B) + 3 A r (O) = 2 11 + 3 16 = 70
2. Дайте определение понятия «молярная масса эквивалента вещества». Приведите пример.
Молярная масса показывает массу 1 моля вещества (обозначается M).
Молярная масса эквивалента вещества масса одного моль эквивалента вещества.(г/моль)
![]()
Z - основность вещества;
Для кислот = числу катионов водорода;
Для основании = числу гидроксогрупп;
Для оксидов и солей равна произведению заряда элемента на число атомов элемента;
3. Дайте определение понятия «количество вещества». Приведите пример.
Количество вещества - это число структурных единиц (атомов, молекул, ионов) в системе. (моль)
Молекулярная масса серы равна 32 г /моль. Определяем количество г/моль вещества в 6,4 г серы
n(s) = m(s) / M(s) = 6,4г / 32 г/моль = 0,2 моль
Дайте определение понятий «моль», «молярная масса». Приведите пример .
Моль – это количество вещества системы, содержащее столько структурных элементов(молекул,атомов,ионов,электронов), сколько их содержится в 0,012 кг изотопа углерода 12 C. M = m / n[г/моль]
Моля́рная ма́сса вещества - масса одного молявещества
Численно равна молекулярной массе.
M H2O = 2 M H +M O = 2·1+16 = 18 (г/моль) Молярная масса вещества равна отношению массы вещества к соответствующему количеству вещества.
Дайте определение понятия «молярный объем газа».
Молярный объем газа - это отношение объема вещ-ва кколичеству этого вещ-ва. V m газа(н.у.)=22,4 л / моль.
Дайте определение понятия «относительная плотность газа». Приведите пример.
Относительная плотность газов отношение масс равных объемов сухого газа и сухого воздуха при одинаковых условиях по температуре и давлению.
Сформулируйте закон сохранения массы и энергии. Формула Эйнштейна. Приведите пример подтверждения закона.
Сумма массы вещества системы и массы, эквивалентной энергии отданной или принятой системой постоянна.
E=m – формула Эйнштейна;
NaOH + HCl NaCl + H2O
40г 36,5г = 58,5г 18г
Сформулируйте закон Авогадро, запишите математическое выражение.
В равных объемах различных газов измеренных при одинаковых условиях содержится одинаковое число молекул.
1 следствие: при н.у. 1 моль любого газа содержит число молекул равное числу Авогадро;
2 следствие: при н.у. 1 моль любого газа занимает объем равный 22,4, называемый молярным объемом;
3 следствие: массы различных газов занимаемых одинаковый объем относятся между собой как их молекулярные массы;
Сформулируйте закон эквивалентов. Запишите его математическое выражение.
Массы реагирующих веществ относятся между собой как молярные массы их эквивалентов.
Эквивалент - это реальная или условная частица вещества, которая в данной кислотно-основной реакции эквивалентна одному протону ил одному электрону в данной окислительно-восстановительной реакции.
Сформулируйте закон действующих масс для скорости химической реакции. Запишите его математическое выражение.
Скорость химической реакции прямо пропорциональна произведению концентраций реагирующих веществ.
aA + bB + .cC+dD
Сформулируйте закон действующих масс для химического равновесия. Запишите его математическое выражение.
Д е йствующих масс зак о н , один из основных законов физической химии; устанавливает зависимость скорости химической реакции от концентраций реагирующих веществ и соотношение между концентрациями (или активностями) продуктов реакции и исходных веществ в состоянии химического равновесия.
Константа скорости реакции, ее физический смысл.
Константа скорости реакции k зависит от природы реагирующих веществ, температуры и катализатора, но не зависит от значения концентраций реагентов.
Физический смысл константы скорости заключается в том, что она равна скорости реакции при единичных концентрациях реагирующих веществ.
Для гетерогенных реакций концентрация твердой фазы в выражение скорости реакции не входит.
Сформулируйте правило Вант-Гоффа. Запишите его математическое выражение.
Правило Ван-Гоффа. С повышением температуры на 10С скорость реакций возрастает в 2-4 раза
V T2 =V t1 * y –T2-T!/10
Температурный коэффициент, его физический смысл.
температурный коэффициент данной реакции;
Схема, электродный процесс и формула расчета электродного потенциала кислородного электрода.
Уравнение Нернста для кислородного электрода при 298 К:
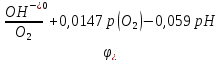
Р-ия на электроде:
![]()
Схема: Pt,
Дайте определение понятий «валентность», «степень окисления». Ответ подтвердите примерами.
Валентность - это способность атомов отдавать или присоединять определённое число электронов.
Степень окисления - это условный заряд атома в молекуле, вычисленный в предположении, что молекула состоит из ионов и в целом электронейтральна.
Наиболее электроотрицательные элементы в соединении имеют отрицательные степени окисления, а атомы элементов с меньшей электроотрицательностью - положительные.
Например:
N 2 H 4 (гидразин)
Степень окисления азота – -2; валентность азота – 3.
Дайте определение понятия «окислительно-восстановительные реакций». Приведите пример.
Реакции, в которых происходит изменение степеней окисления атомов элементов, входящих в состав реагирующих соединений называются окислительно - восстановительными .
2Mg 0 + O 2 0 = 2Mg +2 O -2
Дайте определение понятий «окислитель», «процесс восстановления». Ответ подтвердите примерами.
Атомы или ионы, которые в данной реакции присоединяют электроны являются окислителями.
Процесс присоединения электронов - восстановление : При восстановлении степень окисления понижается.
Mn +4 + 2ē = Mn +2
Дайте определение понятий «восстановитель», «процесс окисления». Ответ подтвердите примерами.
Атомы или ионы, которые в данной реакции отдают электроны являются восстановителями
В окислительно-восстановительных реакциях электроны от одних атомов, молекул или ионов переходят к другим. Процесс отдачи электронов - окисление . При окислении степень окисления повышается:
H 2 0 - 2ē = 2H +
Дайте определение понятия «гальванический элемент». Приведите пример работающего гальванического элемента.
ГЭ –называются ус-ва, в которых энергия хим. р-ций преобразуется в электрическую. Состоит из двух полуэлементов, одним из которых является анод, а другой катод.
А(-) Zn | ZnSO 4 || CuSO 4 | Cu, К(+)
А(-):Zn - 2e = Zn 2+
К(+):Cu 2+ + 2e = Cu
Токообразующая реакция: Cu 2+ + Zn = Cu + Zn 2+
Zn+ CuSO 4 = ZnSO 4 + Cu
Дайте определение понятий «электролиз». Ответ подтвердите примером.
ЭЛЕКТРОЛИЗ - совокупность процессов электрохимического окисления - восстановления, происходящих на погруженных в электролит электродах при прохождении электрического тока.
КI – расплав: KI – раствор:
K(-):+1e=K(-): (): 2
A(+):-2e = A(+): ():=
Суммарный процесс:
2KI 2+2KI + 2HOH++ 2KOH
Стандартный электродный потенциал, его физический смысл.
Стандартный электродный потенциал – величина, характеризующая химическую активность металла, т.е. это разность потенциалов между Ме опущенным в раствор его соли с концентрацией 1 моль/л и стандартным водородным электродом при р=101,3 кПа и Т=298К.
Дайте определение понятия «коррозия металлов». Приведите пример.
Коррозией металлов называют процессы их разрушения, происходящие результата химического воздействия окружающей среды.
1)Хим. коррозия - может происходить и под воздействием на металл некоторых агрессивных жидкостей, и агрессивных газообразных компонентов окружающей среды при выс. t. Основным признаком является то, что она происходит без возникновения в системе электрического тока
2)Электрохимическая коррозия -поверхностное разрушение металла в среде электролита с возникновением в системе электрического тока. Эл. хим. коррозия -это разрушение металла в атмосфере, на почве, в водоемах, грунтах; ей подвергаются всевозможные металлические изделия и сооружения, эксплуатируемые в самых разнообразных условиях
Схема электродный процесс и формула расчета электродного потенциала металлического электрода.
Реакция на электроде:
Ур-ие Нернста: = +
Схема, электродный процесс и формула расчета электродного потенциала водородного электрода.
Реакция на электроде: 2
Схема: Pt,
Уравнение Нернста: +lg
Квантово-механическая модель атома. Квантовые числа, как характеристики состояния электрона в атоме.
Орбиталь - область пространства, в котором наиболее вероятно нахождение электронов.
Главное квантовое число n – определяет энергию и размеры электронных орбиталей, принимает значение 1,2,3,4,5…и характерихует оболочку или энергетический уровень. Чем больше n тем выше энергия.
Орбитальное квантовое число l – определяет форму атомной орбитали.
Орбитальное квантовое число, l…0 1 2 3
Электроны с орбитальным квантовым числом 0, наз-ся s-электронами, элеткронная оболочка имеет сферическую форму. Электроны с орбитально квантовым чилосм 1 назся p – электронами и имеют форму напоминающую гантель.
Магнитное квантовое число m l - характеризует ориентацию орбитали в простарнстве. Магнитное квантовое число принимает целочисленное значение от -1 до +1 включая 0.
Спиновое квантове число m s - характеризует собственное вращательное движение электрона вокруг собственной оси, т.е. показывает величину и ориентацию спина имеет только два значении +1/2 и -1/2
Порядок заполнения орбиталей электронами. Принцип Паули. Правило Хунда, Клечковского.
Принцип Паули: в атоме не может быть двух электронов с одинаковым набором всех 4 квантовых чисел. Распределение электронов по уровням и подуровням описываются с помощью электронных формул и энергетических ячеек.
Правило Гунда: суммарный спин электронов на подуровне должен быть максимальным, т.е. электроны на подуровне стремятся занять максимальное число свободных квантовых состоянии.
Правило Клечковского: заполнение орбиталей происходит от n+l меньших к n+l большим, если сумма n+l равны друг другу, то заполнение орбиталей происходит в порядке возрастания числа n.
Периодический закон Менделеева. Структура периодической системы Д.И.Менделеева: периоды, группы, подгруппы с позиции теории строения атома.
Периодический закон Д. И. Менделеева (1869г) свойства элементов находятся в периодической зависимости от заряда их атомных ядер. Заряд ядра Z равен атомному (порядковому) номеру элемента в системе. Элементы, расположенные по возрастанию Z (H, He, Li, Be...), образуют 7 периодов. В 1-м - 2 элемента, во 2-м и 3-м - по 8, в 4-м и 5-м - по 18, в 6-м - 32. В 7-м периоде (на 1990) известны 23 элемента. В периодах свойства элементов закономерно изменяются при переходе от щелочных металлов к благородным газам. Вертикальные столбцы - группы элементов, сходных по свойствам. Внутри групп свойства элементов также изменяются закономерно (напр., у щелочных металлов при переходе от Li к Fr возрастает химическая активность). Элементы с Z = 58-71, а также с Z = 90-103, особенно сходные по свойствам, образуют 2 семейства-соответственно лантаноиды и актиноиды.Периодичность свойств элементов обусловлена периодическим повторением конфигурации внешних электронных оболочек атомов.С положением элемента в системе связаны его химические и многие физические свойства.
Энергия ионизации, электроотрицательность, энергия сродства к электрону.
Энергия ионизации - разновидность энергии связи или, как ее иногда называют, первый ионизационный потенциал(J1)(для многоэлектронного атома существует также понятие второго, третьего и т.д. ионизационных потенциалов, представляющих собой энергию, удаления электрона от его свободных невозбужденных катионов с зарядами +1 и +2 и т.д.).
Электроотрицательность - фундаментальная хим.свойство атома, количественная характеристика способности атом в молекуле притягивать к себе общие электронные пары. Энергия сродства атома к электрону, или просто его сродством к электрону()называют энергетический эффект процесса присоединения электрона к свободному атому Э в его основном состоянии с превращением его в отрицательный ион Э-(сродство атома к электрону численно равно, но противоположно по знаку энергии ионизации соответсвующего изолированного однозарядника аниона).
Э+е - = Э - +
Ковалентная связь. Насыщаемость и направленность связи.
Ковалентная связь - это химическая связь между атомоми, осуществляемая обобществленными электронами. Обладает - насыщаемостью, обусловленную тем, что при химическом взаимодействии участвуют электроны только внешних энергетических уровней, т.е. ограниченное число электронов; и - направленностью- область перекрывания электронных облаков находится в определенном направлении по отношению к взаимодействующим атомам.
Ионная связь. Металлическая связь.
ИОННАЯ СВЯЗЬ - один из видов химической связи, в основе которой лежит электростатическое взаимодействие между противоположно заряженными ионами. Наиболее ярко выражена в галогенидах щелочных металлов, напр., в NaCl, KF.
Металлическая связь – осуществляется за счет обобществленных свободных электронов взаимодействующих с совокупностью положительных ионов. Образуется у металлов. Все металлы имеют кристаллическую решетку. При образовании связи объединяются электроны всех атомов кристалла. Относится к высокоэнергетическим связям, не обладает насыщаемостью и направленности в пространстве
δ, σ и π связи. Длина связи. Энергия связи.
В зависимости от типа перекрывания орбиталей различают σ-,π- δ-связи. При образовании σ-связи максимальное перекрывание атомных орбиталей происходит на линии, соединяющей центры атомов. При образовании π-связи происходит боковое перекрывание двух р-орбиталей взаимодействующих атомов с образованием максимумов электронной плотности по обе стороны от линии, соединяющей центры атомов. π-Связи обычно менее прочны, чем σ-связи и образуются только тогда, когда между атомами уже есть σ-связи, т.е. в соединениях с двойными и тройными связями. Число связей, образующихся между атомами, называется кратностью связи. δ-Связи образуются при перекрывании d -орбиталей, расположенных в параллельных плоскостях. Такой тип связи встречается в комплексных соединениях d -металлов. Ковалентная связь может образовываться по двум механизмам: обменному и донорно-акцепторному. В случае обменного механизма каждый из связывающихся атомов представляет по одному электрону для образования связи, при донорно-акцепторной связи один атом предоставляет два электрона(неопределенную пару), а другой - свободную орбиталь.
Водородная связь. Механизм образования водородной связи.
Водородная связь – разновидность донорно-акцепторной связи, невалентное взаимодействие между атомом водорода Н, ковалентно связанным с атом А группы А-Н молекулы RА-Н и электроотрицательным атомом B другой молекулы(или функциональной группы той же молекулы) ВR’. Результатом таких взаимодействии являются комплексы RA-HBR’ различной степени стабильности, в которых атом водорода выступает в роли моста, связывающего фрагменты RA и BR’.
Основные положения теории валентных связей. Гибридизация.
Гибридизация орбиталей - концепция смешения разных, но близких по энергииорбиталейданногоатома, с возникновением того же числа новых гибридных орбиталей, одинаковых поэнергиииформе. Гибридизация атомных орбиталей происходит при возникновенииковалентной связимежду атомами. Гибридизация орбиталей очень полезна при объяснении формы молекулярных орбиталей и является интегральной частьютеории валентных связей. Теория гибридизации была предложена американским химикомЛайнусом Полингомдля объяснения структуры таких молекул какметан. Исторически применялась только для простых молекул, но позднее была расширена и для более сложных. В отличие оттеории молекулярных орбиталейне является строго количественной, например она не в состоянии предсказать фотоэлектронные спектры даже таких простых молекул как вода. Поэтому в настоящее время используется в основном впедагогических целяхи в синтетическойорганической химии.sp³-гибридизация Четыре sp ³ орбитали. Происходит при смешивании одной s- и трех p-орбиталей. Возникают четыре одинаковые орбитали, расположенные относительно друг друга под тетраэдрическимиуглами 109° 28’ (109,47°), длина 0,154 нм.sp²-гибридизация. Три sp ² орбитали. Происходит при смешивании одной s- и двух p-орбиталей. Образуется три гибридные орбитали с осями, расположенными в одной плоскостии направленными к вершинам треугольника под углом 120 градусов. Негибридная p-атомная орбиталь перпендикулярна плоскости и, как правило, участвует в образовании π-связей, длина 0,134 нм.sp-гибридизация Происходит при смешивании одной s- и одной p-орбиталей. Образуется две равноценные sp-атомные орбитали, расположенные линейно под углом 180 градусов и направленные в разные стороны от ядра атома углерода. Две оставшиеся негибридные p-орбитали располагаются во взаимно перпендикулярных плоскостях и участвуют в образовании π-связей, либо занимаются неподелёнными парами электронов, длина 0,120 нм.
Влияние концентрации реагирующих веществ на скорость химической реакции. Закон действующих масс. Константа скорости химической реакции.
Гульдбергом и Вааге был сформулирован закон действующих масс, устанавливающий зависимость скорости реакции от концентрации реагирующих веществ: скорость хим.реакции при данной температуре прямо пропорционально произведению концентрации реагирующих веществ в степенях с показателями, равными стехиометрическим коэффициентам в уравнении реакции – это основной закон хим.кинетики. Для реакции nA + mB = A n B m этот закон выразится уравнением:
V=k[A] n [B] m , k – константа скорости;
Влияние температуры на скорость химической реакции. Правило Вант-Гоффа. Уравнение Аррениуса. Энергия активации, ее физический смысл.
Скорость реакции зависит от природы реагирующих веществ, концентрации реагентов, температуры, внешних воздействии. По правилу Вант-Гофа при увелечении температуры на 10 градусов скорость большинства реакции возрастает в 2-4 раза:
Аррениус установил функциональную зависимость константы скорости хим.реакции k от t: k= A*
где А - предэкспонциональный множитель, представляющий собой полную частоту соударения между молекулами реагирующих веществ,
атом
А́ТОМ м. греч. неделимое; вещество в крайних пределах делимости своей, незримая пылинка, из каких будто бы составлены все тела, всякое вещество, как бы из песчинок. || Неизмеримая, бесконечно малая пылинка, ничтожное количество. || У химиков слово атом принимает значение меры сродства тел: один атом кислорода поглощает один, два, три атома железа, значит: вещества эти соединяются в таком кратном отношении. Атоми́зм м. атомисти́ческое, атоми́ческое учение, в физике, принимающее за основание, что всякое вещество состоит из неделимых атомов; атоми́стика ж. наука, знание это; атоми́ст м. ученый, который держится этого убеждения. Ему противополагается дина́мик, динами́ческая школа, отвергающая предел делимости вещества и признающая его за выражение, проявление сил в нашем мире.
Что такое атом , атом это, значение слова атом , происхождение (этимология) атом , синонимы к атом , парадигма (формы слова) атом в других словарях
атом - Словарь иностранных слов
2. перен. Об атомной энергии. На службу человеку поставлен атом. Атомник (разг. ) - специалист по атомной энергии. Атомщик (разг. ) - 1) то же, что атомник; 2) устар. сторонник применения атомной бомбы.
атом - Т.Ф. Ефремова Новый словарь русского языка. Толково- словообразовательный
что такое атом
атом
а ́том
м.1) Мельчайшая электрически нейтральная частица химического элемента, являющаяся носителем его свойств.
2) перен. разг. Атомная энергия.
атом - Современный толковый словарь изд. «Большая Советская Энциклопедия»
что такое атом
АТОМ
(от греч. atomos - неделимый), мельчайшая частица химического элемента, сохраняющая его свойства. В центре атома находится положительно заряженное ядро, в котором сосредоточена почти вся масса атома; вокруг движутся электроны, образующие электронные оболочки, размеры которых (АТОМ10-8 см) определяют размеры атома. Ядро атома состоит из протонов и нейтронов. Число электронов в атоме равно числу протонов в ядре (заряд всех электронов атома равен заряду ядра), число протонов равно порядковому номеру элемента в периодической системе. Атомы могут присоединять или отдавать электроны, становясь отрицательно или положительно заряженными ионами. Химические свойства атомов определяются в основном числом электронов во внешней оболочке; соединяясь химически, атомы образуют молекулы. Важная характеристика атома - его внутренняя энергия, которая может принимать лишь определенные (дискретные) значения, соответствующие устойчивым состояниям атома, и изменяется только скачкообразно путем квантового перехода. Поглощая определенную порцию энергии, атом переходит в возбужденное состояние (на более высокий уровень энергии). Из возбужденного состояния атом, испуская фотон, может перейти в состояние с меньшей энергией (на более низкий уровень энергии). Уровень, соответствующий минимальной энергии атома, называется основным, остальные - возбужденными. Квантовые переходы обусловливают атомные спектры поглощения и испускания, индивидуальные для атомов всех химических элементов.



