Насыщенный пар и его свойства влажность воздуха. Что характерно для насыщенного газа с молекулярной точки зрения. Плавление и кристаллизация
При естественных условиях пар считают газом. Он может быть насыщенным и нена-сыщенным , что зависит от его плотности, температуры и давления.
Пар, находящийся в динамическом равновесии с собственной жидкостью, является насыщенным .
Динами-ческое равновесие между жидкостью и па-ром возникает тогда, когда количество мо-лекул, вылетающих из свободной повер-хности жидкости, равно количеству моле-кул, возвращающихся в нее.
В открытом сосуде нарушается динами-ческое равновесие, и пар становится нена-сыщенным , поскольку определенное коли-чество молекул испаряется в атмосферу и не возвращается в жидкость.
Насыщенный пар образуется в закрытом сосуде над свобод-ной поверхностью жидкости.
Насыщенный и ненасыщенный пар име-ют разные свойства. Исследуем их.
| Рис. 3.2. Изотермическое сжатие пара |
Концентрация молекул насы-щенного пара не зависит от его объема.
Пусть ненасыщенный пар при темпе-ратуре T находится в цилиндре с поршнем (рис. 3.2). Начнем медленно его сжимать, чтобы обеспечить изотермический процесс (участок AB). Сначала, если пар значитель-но разреженный, зависимость давления от объема будет соответствовать закону Бой-ля-Мариотта для идеального газа: pV = const. Тем не менее с уменьшением объема ненасыщенного пара (увеличением его плотности) начинает наблюдаться откло-нение от него. Дальнейшее изотермическое сжатие пара ведет к тому, что он начинает конденсироваться (точка В), в цилиндре образуются капельки жидкости и пар ста-новится насыщенным. Его плотность, а следовательно и концентрация молекул, при-обретает максимальное значение для данной температуры. Они не зависят от объема, который занимает насыщенный пар, и оп-ределяются его давлением и температурой.
При сжатии насыщенного пара (участок BC) его давление не будет изменяться (p = const). Это объясняется тем, что с умень-шением объема насыщенный пар конден-сируется, образовывая жидкость. Ее доля в объеме цилиндра все время увеличивается, а объем, который занимает насыщенный пар, уменьшается. Это происходит до тех пор, пока весь насыщенный пар не пере-йдет в жидкое состояние (точка C).
Дальнейшее уменьшение объема вызы-вает стремительное возрастание давления (участок DC), поскольку жидкости почти не сжимаются. Материал с сайта
Итак, при изотермическом сжатии не-насыщенного пара сначала (при незначи-тельной плотности) он проявляет свойства идеального газа. Когда же пар становится насыщенным , его свойства подчиняются дру-гим закономерностям. В частности, при не-высоких температурах его состояние при-близительно описывается уравнением p = nkT, когда концентрация молекул не зависит от объема, занимаемого газом. График зави-симости давления p от объема V, изобра-женный на рис. 3.2, называется изотермой реальных газов .
Изотермы реального газа ха-рактеризуют его равновесное состояние с жидкостью. Их совместимость позволяет оп-ределить зависимость давле-ния насыщенного пара от тем-пературы.
На этой странице материал по темам:
Что характерно для насыщенного пара с молекулярной точки зрения
Що характерно з молекулярної точки зору для насиченої пари
Что характерно для насыщенного газа с молекулярной точки зрения
Научное познание краткий конспект
Насыщенный пар краткий конспект
Вопросы по этому материалу:
Тема 2. ФАЗОВЫЕ ПЕРЕХОДЫ.
Фазовый переход (фазовое превращение) – это переход вещества из одной фазы в другую при изменении внешних русловий (например, температуры, давления, магнитного и электрического полей и т.д.), сопровождающееся изменением физических свойств и параметров вещества.
Значение температуры, давления или какой-либо другой физической величины, при котором происходит Фазовый переход, называют точкой перехода. Различают Фазовый переход двух родов.
ФАЗОВЫЕ ПЕРЕХОДЫ ПЕРВОГО РОДА
При фазовом переходе первого рода скачком меняются такие термодинамические
характеристики вещества, как плотность, концентрация компонент, удельный объём, количество запасённой внутренней энергии, т.е. выделяется или поглощается определённое количество теплоты, носящее название теплоты перехода. Причем имеется в виду скачкообразное изменение этих величин не во времени, а при изменении температуры, давления и т. п. Наиболее распространённые примеры фазовых переходов первого рода:
- плавление и кристаллизация
- испарение и конденсация
- сублимация и десублимация
ФАЗОВЫЕ ПЕРЕХОДЫ ВТОРОГО РОДА
При фазовом переходе второго рода плотность и внутренняя энергия не меняются, так что невооружённым глазом такой фазовый переход может быть незаметен. Скачок же испытывают их производные по температуре и давлению: теплоёмкость, коэффициент теплового расширения, различные восприимчивости и т. д. Т.е. фазовые переходы второго рода сопровождаются изменением симметрии строения вещества, а не выделением или поглощением энергии (теплоты). Наиболее распространённые примеры фазовых переходов второго рода:
- прохождение системы через критическую точку
- переход парамагнетик-ферромагнетик
- переход металлов и сплавов в состояние сверхпроводимости
- переход жидкого гелия в сверхтекучее состояние
- переход аморфных материалов в стеклообразное состояние
Современная физика исследует также системы, обладающие фазовыми переходами третьего или более высокого рода. В последнее время широкое распространение получило понятие квантовый фазовый переход, т.е. фазовый переход, управляемый не классическими тепловыми флуктуациями, а квантовыми, которые существуют даже при абсолютном нуле температур, где классический фазовый переход не может реализоваться вследствие теоремы Нернста .
Рассмотрим более подробно интересующие нас явления, связанные с фазовыми переходами первого рода.
ИСПАРЕНИЕ, КОНДЕНСАЦИЯ, КИПЕНИЕ.
НАСЫЩЕННЫЕ И НЕНАСЫЩЕННЫЕ ПАРЫ.
Любое вещество при определенных условиях может находиться в различных агрегатных состояниях – твердом, жидком и газообразном. Переходы из одного агрегатного состояния во второе являются фазовыми переходами I рода.
Испарение и конденсация являются фазовыми переходами между жидкой и газообразной фазой вещества..
Все реальные газы (кислород, азот, водород и т. д.) при определенных условиях способны превращаться в жидкость. Однако такое превращение может происходить только при температурах ниже определенной, так называемой критической температуры T кр. Например, для воды критическая температура равна 647,3 К, для азота 126 К, для кислорода 154,3 К. При комнатной температуре (≈ 300 К) вода может находиться и в жидком, и в газообразном состояниях, а азот и кислород существуют только в виде газов.
Испарением называется фазовый переход из жидкого состояния в газообразное. С точки зрения молекулярно-кинетической теории, испарение – это процесс, при котором с поверхности жидкости вылетают наиболее быстрые молекулы, кинетическая энергия которых превышает энергию их связи с остальными молекулами жидкости. Это приводит к уменьшению средней кинетической энергии оставшихся молекул, т. е. к охлаждению жидкости (если нет подвода энергии от окружающих тел).
Конденсация – это процесс, обратный процессу испарения. При конденсации молекулы пара возвращаются в жидкость.
В закрытом сосуде жидкость и ее пар могут находиться в состоянии динамического равновесия , когда число молекул, вылетающих из жидкости, равно числу молекул, возвращающихся в жидкость из пара, т. е. когда скорости процессов испарения и конденсации одинаковы. Такую систему называют двухфазной . Пар, находящийся в равновесии со своей жидкостью, называют насыщенным .
Число молекул, вылетающих с единицы площади поверхности жидкости за одну секунду, зависит от температуры жидкости. Число молекул, возвращающихся из пара в жидкость, зависит от концентрации молекул пара и от средней скорости их теплового движения, которая определяется температурой пара. Отсюда следует, что для данного вещества концентрация молекул пара при равновесии жидкости и ее пара определяется их равновесной температурой. Установление динамического равновесия между процессами испарения и конденсации при повышении температуры происходит при более высоких концентрациях молекул пара. Так как давление газа (пара) определяется его концентрацией и температурой, то можно сделать вывод: давление насыщенного пара p 0 данного вещества зависит только от его температуры и не зависит от объема . Поэтому изотермы реальных газов на плоскости (p , V ) содержат горизонтальные участки, соответствующие двухфазной системе (рис. 3.4.1).
При повышении температуры давление насыщенного пара и его плотность возрастают, а плотность жидкости уменьшается из-за теплового расширения. При температуре, равной критической температуре T кр для данного вещества, плотности пара и жидкости становятся одинаковыми. При T > T кр исчезают физические различия между жидкостью и ее насыщенным паром.
Если изотермически сжимать ненасыщенный пар при T < T кр, то его давление будет возрастать, пока не станет равным давлению насыщенного пара. При дальнейшем уменьшении объема на дне сосуда образуется жидкость и устанавливается динамическое равновесие между жидкостью и ее насыщенным паром. С уменьшением объема все большая часть пара конденсируется, а его давление остается неизменным (горизонтальный участок на изотерме). Когда весь пар превращается в жидкость, давление резко возрастает при дальнейшем уменьшении объема вследствие малой сжимаемости жидкости.
Из газообразного состояния в жидкое можно перейти, минуя двухфазную область. Для этого нужно совершить процесс в обход критической точки K . Один из возможных процессов такого рода показан на рис.1 ломаной линией ABC .
В атмосферном воздухе всегда присутствуют пары воды при некотором парциальном давлении p , которое, как правило, меньше давления насыщенного пара p 0 . Отношение p / p 0 , выраженное в процентах, называется относительной влажностью воздуха.
| |
Ненасыщенный пар можно теоретически описывать с помощью уравнения состояния идеального газа при обычных для реальных газов ограничениях: давление пара должно быть не слишком велико (практически p ≤ (10 6 –10 7) Па), а его температура выше некоторого определенного для каждого вещества значения. К насыщенному пару также можно приближенно применять законы идеального газа при условии, что для каждой температуры T давление p 0 насыщенного пара определяется по кривой равновесия p 0 (T ) для данного вещества.
Давление p 0 насыщенного пара очень быстро возрастает с ростом температуры T . Зависимость p 0 (T ) нельзя получить из законов идеального газа. Давление газа при постоянной концентрации молекул растет прямо пропорционально температуре. В насыщенном паре при повышении температуры возрастает не только средняя кинетическая энергия движения молекул, но и их концентрация. Поэтому давление насыщенного пара при повышении температуры возрастает быстрее, чем давление идеального газа при постоянной концентрации молекул.
Испарение может происходить не только с поверхности, но и в объеме жидкости. В жидкости всегда имеются мельчайшие пузырьки газа. Если давление насыщенного пара жидкости равно внешнему давлению (т. е. давлению газа в пузырьках) или превышает его, жидкость будет испаряться внутрь пузырьков. Пузырьки, наполненные паром, расширяются и всплывают на поверхность. Этот процесс называется кипением . Таким образом, кипение жидкости начинается при такой температуре, при которой давление ее насыщенных паров становится равным внешнему давлению .
В частности, при нормальном атмосферном давлении вода кипит при температуре 100 °С. Это значит, что при такой температуре давление насыщенных паров воды равно 1 атм. При подъеме в горы атмосферное давление уменьшается, и поэтому температура кипения воды понижается (приблизительно на 1 °С на каждые 300 метров высоты). На высоте 7 км давление составляет примерно 0,4 атм, и температура кипения понижается до 70 °С.
В герметически закрытом сосуде жидкость кипеть не может, т. к. при каждом значении температуры устанавливается равновесие между жидкостью и ее насыщенным паром. По кривой равновесия p 0 (T ) можно определять температуру кипения жидкости при различных давлениях.
Изображенная на рис.1 картина изотерм реального газа описывает процессы испарения и конденсации, т. е. фазовый переход между газообразной и жидкой фазами вещества. На самом деле эта картина является неполной, т. к. из газообразного и жидкого любое вещество может перейти в твердое состояние. При заданной температуре T термодинамическое равновесие между двумя фазами одного и того же вещества возможно лишь при определенном значении давления в системе. Зависимость равновесного давления от температуры называется кривой фазового равновесия . Примером может служить кривая равновесия p 0 (T )насыщенного пара и жидкости. Если кривые равновесия между различными фазами данного вещества построить на плоскости (p , T ), то они разбивают эту плоскость на отдельные области, в которых вещество существует в однородном агрегатном состоянии – твердом, жидком или газообразном (рис. 2). Изображенные в координатной системе (p , T ) кривые равновесия называются фазовой диаграммой .
Кривая 0T , соответствующая равновесию между твердой и газообразной фазами, называется кривой сублимации . Кривая TK равновесия между жидкостью и паром называется кривой испарения , она обрывается в критической точке K . Кривая TM равновесия между твердым телом и жидкостью называется кривой плавления .
Кривые равновесия сходятся в точке T , в которой могут сосуществовать в равновесии все три фазы. Эта точка называется тройной точкой .
Для многих веществ давление p тр в тройной точке меньше 1 атм ≈ 10 5 Па. Такие вещества при нагревании при атмосферном давлении плавятся. Например, тройная точка воды (рис. 3) имеет координаты T тр = 273,16 К, p тр = 6,02·10 2 Па и используется в качестве опорной для калибровки абсолютной температурной шкалы Кельвина.
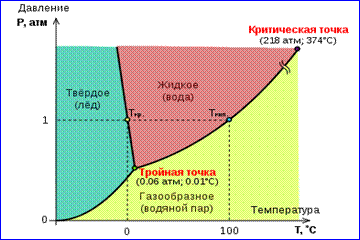 Существуют, однако, и такие Рис. 3 Фазовая диаграмма воды
Существуют, однако, и такие Рис. 3 Фазовая диаграмма воды
вещества, у которых p тр
превышает 1 атм. Так для
углекислоты (CO 2) давление
p тр = 5,11 атм и температура
T тр = 216,5 К. Поэтому при атмосферном
давлении твердая углекислота может
существовать только при низкой температуре, а в жидком состоянии при p = 1 атм она вообще не существует. В твердом состоянии в равновесии со своим паром при атмосферном давлении углекислота находится при температуре 173 К или –80 °С. Это широко применяемый «сухой лед», который никогда не плавится, а только испаряется (сублимирует).
Жидкости имеют свойство испаряться. Если бы мы капнули на стол по капле воды, эфира и ртути (только не делайте этого в домашних условиях!), смогли бы наблюдать, как постепенно капли исчезают – испаряются. Одни жидкости испаряются быстрее, другие медленнее. Процесс испарения жидкости еще называется парообразованием. А обратный процесс превращения пара в жидкость – конденсацией.
Эти два процесса иллюстрируют фазовый переход – процесс перехода веществ из одного агрегатного состояния в другое:
- испарение (переход из жидкого в газообразное состояние);
- конденсация (переход из газообразного состояния в жидкое);
- десублимация (переход из газообразного состояния в твердое, минуя жидкую фазу);
- возгонка, она же сублимация (переход из твердого в газообразное состояние, минуя жидкое).
Сейчас, к слову, подходящий сезон, чтобы наблюдать процесс десублимации в природе: иней и изморозь на деревьях и предметах, морозные узоры на окнах – ее результат.
Как образуется насыщенный и ненасыщенный пар
Но вернемся к парообразованию. Мы продолжим экспериментировать и нальем жидкость – воду, например, в открытый сосуд, а к нему подсоединим манометр. Невидимое глазу, в сосуде происходит испарение. Все молекулы жидкости находятся в непрерывном движении. Некоторые движутся так быстро, что их кинетическая энергия оказывается сильнее той, что связывает молекулы жидкости вместе.
Покинув жидкость, эти молекулы продолжают хаотически двигаться в пространстве, подавляющее их большинство рассеивается в нем – так образуется ненасыщенный пар . Лишь небольшая их часть возвращается обратно в жидкость.
Если закроем сосуд, молекул пара постепенно будет становиться все больше. И все больше их будет возвращаться в жидкость. При этом будет увеличиваться давление пара. Это зафиксирует подсоединенный к сосуду манометр.
Спустя какое-то время число молекул, вылетающих из жидкости и возвращающихся в нее, сравняется. Давление пара перестанет изменяться. В результате насыщения пара установится термодинамическое равновесие системы жидкость-пар. То есть испарение и конденсация будут равны.
Свойства насыщенного пара
Чтобы их проиллюстрировать наглядно, используем еще один эксперимент. Призовите всю силу своего воображения, чтобы представить его. Итак, возьмем ртутный манометр, состоящий из двух колен – сообщающихся трубок. В оба налита ртуть, один конец открыт, второй запаян и над ртутью в нем находится еще некоторое количество эфира и его насыщенного пара. Если опускать и поднимать не запаянное колено, уровень ртути в запаянном будет также опускаться и подниматься.
При этом будет изменяться и количество (объем) насыщенного пара эфира. Разность уровней ртутных столбиков в обоих коленах манометра показывает давление насыщенного пара эфира. Оно будет сохраняться неизменным все время.
Отсюда вытекает свойство насыщенного пара – его давление не зависит от занимаемого им объема. Давление насыщенных паров различных жидкостей (воды и эфира, к примеру) разное при одинаковой температуре.
Однако температура насыщенного пара имеет значение. Чем выше температура, тем выше и давление. Давление насыщенного пара с увеличением температуры возрастает быстрее, чем это происходит с ненасыщенным паром. Температура и давление ненасыщенного пара связаны линейной зависимостью.
Можно провести еще один любопытный опыт. Взять пустую колбу без паров жидкости, закрыть ее и подсоединить манометр. Постепенно, по капле, подавать внутрь колбы жидкость. По мере поступления жидкости и ее испарения устанавливается давление насыщенного пара, наибольшее для данной жидкости при данной температуре.
Еще о температуре и насыщенном паре
Температура пара влияет и на скорость конденсации. Так же, как температура жидкости определяет скорость испарения – число молекул, которые вылетают с поверхности жидкости в единицу времени, другими словами.
У насыщенного пара его температура равна температуре жидкости. Чем выше температура насыщенного пара, тем выше его давление и плотность, ниже плотность жидкости. При достижении критической для вещества температуры плотность жидкости и пара одинаковая. Если температура пара выше критической для вещества температуры, физические различия между жидкостью и насыщенным паром стираются.
Определение давления насыщенного пара в смеси с другими газами
Мы сказали о неизменном при постоянной температуре давлении насыщенного пара. Мы определяли давление в «идеальных» условиях: когда в сосуде или колбе присутствуют жидкость и пар только одного вещества. Рассмотрим еще эксперимент, в котором молекулы вещества рассеяны в пространстве в смеси с другими газами.
Для этого возьмем два открытых стеклянных цилиндра и поместим в оба закрытые сосуды с эфиром. Как водится, подсоединим манометры. Один сосуд с эфиром раскрываем, после чего манометр фиксирует повышение давления. Разность между этим давлением и давлением в цилиндре с закрытым сосудом эфира и позволяет узнать давление насыщенного пара эфира.
О давлении и кипении
Испарение возможно не только с поверхности жидкости, но и в ее объеме – тогда его называют кипением. При повышении температуры жидкости образуются пузырьки пара. Когда давление насыщенного пара больше либо равно давлению газа в пузырьках, жидкость испаряется внутрь пузырьков. А те расширяются и поднимаются на поверхность.
Жидкости кипят при разных температурах. В обычных условиях вода закипает при 100 0 С. Но с изменением атмосферного давления меняется и температура кипения. Так, в горах, где воздух сильно разрежен и атмосферное давление ниже, по мере подъема в горы снижается и температура кипения воды.
Кстати, в герметично закрытом сосуде кипение невозможно вообще.
![]()
Еще один пример взаимосвязи давления пара и испарения демонстрирует такая характеристика содержания паров воды в воздухе, как относительная влажность воздуха. Она представляет собой отношение парциального давления паров воды к давлению насыщенного пара и определяется по формуле: φ = р/р о * 100%.
При понижении температуры воздуха концентрация водяных паров в нем повышается, т.е. они становятся более насыщенными. Эта температура называется точкой росы.
Подведем итоги
На несложных примерах мы разобрали суть процесса испарения и образующиеся в его результате ненасыщенный и насыщенный пар. Все эти явления вы ежедневно можете наблюдать вокруг себя: например, видеть высыхающие после дождя лужи на улицах или запотевшее от пара зеркало в ванной комнате. В ванной вы даже можете наблюдать, как сначала происходит парообразование, а потом конденсация скопившейся на зеркале влаги обратно в воду.
Вы также можете использовать эти знания, чтобы сделать свою жизнь более комфортной. Например, зимой во многих квартирах воздух очень сухой, и это плохо сказывается на самочувствии. Вы можете использовать современный прибор-увлажнитель, чтобы сделать его более влажным. Или по старинке поставить в комнате емкость с водой: постепенно испаряясь, вода насытит воздух своими парами.
www.сайт, при полном или частичном копировании материала ссылка на первоисточник обязательна.
Наверняка многим приходилось наблюдать картину, как стоящая открытой емкость с водой через некоторое время оказывается пустой. Если же ее прикрыть крышкой, то вода никуда не девается. Причина всем известна - вода испаряется. Объяснение такому явлению простое: часть молекул воды имеет достаточно большую скорость движения для того, чтобы покинуть жидкость. Вот этот процесс перехода жидкости в газообразное состояние и называется испарением.
Другой процесс, а именно превращение пара в жидкость, называется конденсацией. Эти два процесса, испарение и конденсация, идут постоянно: часть воды испаряется, часть - конденсируется. Если объем над поверхностью воды неограничен, то преобладает процесс испарения. Испарившаяся вода удаляется, как, например, происходит над поверхностью открытой воды, и жидкость постепенно переходит в газообразное состояние - пар.
А вот если объем свободного пространства над жидкостью ограничен, то возникает несколько другая ситуация. Испарившаяся вода не может покинуть этот объем, и над поверхностью воды образуется насыщенный пар. Так называется пар, находящийся в состоянии равновесия, когда количество испарившейся воды и конденсировавшегося пара равны. Вода не убывает и не прибывает, наступает состояние равновесия между испарением и конденсацией.
Теперь мы знаем, что такое насыщенный пар, и его свойства, возможно, окажутся для нас достаточно любопытными. Мы с самого начала определили, что объем свободного пространства над поверхностью жидкости ограничен. Над ней образовался насыщенный пар. А если теперь этот свободный объем уменьшить? Что будет? В этом случае установившееся равновесие между конденсацией и испарением нарушится. Начнет преобладать процесс конденсации, объем влаги увеличится, а пара - уменьшится.
Давление пара, при котором он находится в равновесии с жидкостью, называется Если мы уменьшаем объем свободного пространства над водой, то давление пара увеличивается. Следствием этого и будет переход пара в воду. При увеличенном занимает меньше места, чем насыщенный пар. Из этого следует еще один вывод: если температура постоянна, то давление насыщенного пара при любом объеме одинаково.
Существует еще один вариант поведения пара - объем над поверхностью воды уменьшают, а переход пара в жидкость не происходит. Значит, над поверхностью находится ненасыщенный пар. В дальнейшем, при уменьшении объема при постоянной температуре, пар начинает превращаться в воду - значит, образовался насыщенный пар. Но не зря было оговорено условие, что все происходит при постоянной температуре. Существует определенное ее значение, при котором пар может превратиться в жидкость.
Это значение называется критической температурой. Вещество остается газом при температуре выше критической, если же она ниже критической, то газ превращается в жидкость. Каждое вещество имеет свое значение Стоит отметить еще две особенности пара: он может быть как влажный, так и сухой насыщенный пар. Во влажном присутствуют капли воды, а сухой пар не содержит влаги.
Существует еще так называемый перегретый пар - это сухой пар с температурой выше критической. В этом случае считается, что в замкнутом объеме уже нет жидкости, а присутствует исключительно пар. Перегретый пар в основном используется в технике и энергетике. перегретого пара позволяет транспортировать его с помощью паропроводов и использовать в Благодаря отсутствию воды в перегретом паре срок службы турбины увеличивается.
В статье рассмотрено, что собой представляет насыщенный пар, его виды и свойства, а также процесс его образования и превращения в жидкость.



