Что такое заряд ядра атома в физике
Строение атома – это одна из базовых тем курса химии, которая основана на умении пользоваться таблицей «Периодическая система химических элементов Д.И.Менделеева». Это не только систематизированные и расположенные по определенным законам химические элементы, но и кладезь информации, в том числе и о строении атома. Зная особенности чтения этого уникального справочного материала, можно дать полную качественную и количественную характеристику атому.
Вам понадобится
Таблица Д.И.Менделеева
Спонсор размещения P&G Статьи по теме "Как определить заряд ядра атома" Как читать таблицу Менделеева Как найти заряд ядра Почему изменяются металлические свойства
Инструкция
В таблице Д.И.Менделеева, как в многоэтажном многоквартирном доме «живут» химические элементы, каждый из которых занимает свою собственную квартиру. Таким образом, каждый из элементов имеет определенный порядковый номер, указанный в таблице. Нумерация химических элементов начинается слева направо, причем сверху.
В таблице горизонтальные ряды называются периодами, а вертикальные столбцы – группами. Это немаловажно, потому что по номеру группы или периода можно также дать характеристику некоторым параметрам атома.
Атом представляет собой химически неделимую частицу, но при этом состоящую из более мелких составных частей, к которым можно отнести протоны (положительно заряженные частицы), электроны (заряжены отрицательно) и нейтроны (нейтральные частицы). Основная масса атома сосредоточена в ядре (за счет протонов и нейтронов), вокруг которого вращаются электроны. В целом атом электронейтрален, то есть в нем количество положительных зарядов совпадает с количеством отрицательных, следовательно, число протонов и электронов одинаково. Положительный заряд ядра атома имеет место быть как раз за счет протонов.
Необходимо запомнить, что порядковый номер химического элемента количественно совпадает с зарядом ядра атома. Поэтому, чтобы определить заряд ядра атома необходимо посмотреть, под каким номером находится данный химический элемент.
Пример № 1. Определить заряд ядра атома углерода (С). Начинаем анализировать химический элемент углерод, ориентируясь на таблицу Д.И.Менделеева. Углерод находится в «квартире» № 6. Следовательно, он имеет заряд ядра +6 за счет 6 протонов (положительно заряженных частиц), которые располагаются в ядре. Учитывая, что атом электронейтрален, значит, электронов тоже будет 6.
Пример № 2. Определить заряд ядра атома алюминия (Al). Алюминий имеет порядковый номер - № 13. Следовательно, заряд ядра атома алюминия +13 (за счет 13 протонов). Электронов также будет 13.
Пример № 3. Определить заряд ядра атома серебра (Ag). Серебро имеет порядковый номер - № 47. Значит, заряд ядра атома серебра + 47 (за счет 47 протонов). Электронов также 47.
Как простоДругие новости по теме:
Атом любого химического элемента состоит из атомного ядра и, обращающихся вокруг него, электронов. А из чего состоит атомное ядро? В 1932 году было установлено, что атомное ядро состоит из протонов и нейтронов. Вам понадобится - периодическая таблица химических элементов Д.И. Менделеева.
Чтобы найти количество протонов в атоме, определите его место в таблице Менделеева. Найдите его порядковый номер в периодической таблице. Он будет равен количеству протонов в атомном ядре. Если исследуется изотоп, посмотрите на пару чисел, описывающие его свойства, нижнее число будет равно
Для определения количества протонов в атоме найдите элемент таблицы Менделеева, отображающий свойства данного атома. Его порядковый номер в таблице и будет отображать число протонов в ядре атома. Количество протонов можно найти, зная заряд ядра атома, а также количество электронов в нем. Вам
Заряд атома, наряду с его квантовыми числами, является одной из важнейших числовых характеристик атома. Знание заряда атома необходимо для решения различных задач электростатики, электродинамики, атомной и ядерной физики. Вам понадобится Знание структуры атома, атомный номер Спонсор размещения P&G
В силу определенных причин атомы и молекулы могут либо приобретать, либо терять свои электроны. В этом случае образуется ион. Таким образом, ион - это одноатомная или многоатомная заряженная частица. Очевидно, важнейшей характеристикой иона будет его заряд. Вам понадобится Таблица химических
Атом химического элемента состоит из ядра и электронной оболочки. Ядро - это центральная часть атома, в котором сосредоточена почти вся его масса. В отличие от электронной оболочки, ядро имеет положительный заряд. Вам понадобится Атомный номер химического элемента, закон Мозли Спонсор размещения
Атом – мельчайшая частица каждого элемента, которая несет его химические свойства. Как существование, так и строение атома являлось предметом рассуждений и изучений с древних времен. Было установлено, что строение атомов сродни строению Солнечной системы: в центре ядро, занимающее очень мало места,
Физические свойства атомных ядер. Заряд ядра. Размер ядра. Моменты ядер. Спин ядра. Магнитный и электрический моменты ядра. Масса ядра и масса атома. Дефект массы. Энергия связи. Основные особенности энергии связи. Основное правило. Ядерные силы: основные характеристики, кулоновский и ядерный потенциалы ядра. Обменный характер ядерных сил.
Закон Мозли. Электрический заряд ядра образуют протоны, входящие в его состав. Число протонов Z называют его зарядом, имея ввиду, что абсолютное значение заряда ядра равно Ze. Заряд ядра совпадает с порядковым номером Z элемента в периодической системе элементов Менделеева. Впервые заряды атомных ядер определил английский физик Мозли в 1913 году. Измерив с помощью кристалла длину волны λ характеристического рентгеновского излучения для атомов некоторых элементов, Мозли обнаружил регулярное изменение длины волны λ у элементов, следующих друг за другом в периодической системе (рис.2.1). Это наблюдение Мозли интерпретировал зависимостью λ от некоторой константы атома Z , изменяющейся на единицу от элемента к элементу и равной единице для водорода:
где и - постоянные. Из экспериментов по рассеянию рентгеновских квантов атомными электронами и α -частиц атомными ядрами уже было известно, что заряд ядра примерно равен половине атомной массы и, следовательно, близок к порядковому номеру элемента. Поскольку испускание характеристического рентгеновского излучения является следствием электрических процессов в атоме, Мозли сделал вывод, что найденная в его опытах константа атомов, определяющая длину волны характеристического рентгеновского излучения и совпадающая с порядковым номером элемента, может быть только зарядом атомного ядра (закон Мозли).

Рис. 2.1. Рентгеновские спектры атомов соседних элементов, полученные Мозли
Измерение длин волн рентгеновского излучения выполняется с большой точностью, так что на основе закона Мозли принадлежность атома к химическому элементу устанавливается абсолютно надежно. Вместе с тем тот факт, что константа Z в последнем уравнении является зарядом ядра, хотя и обоснован косвенными экспериментами, в конечном счете держится на постулате – законе Мозли. Поэтому после открытия Мозли заряды ядер многократно измерялись в опытах по рассеянию α -частиц на основе закона Кулона. В 1920 году Чедвиг усовершенствовал методику измерения доли рассеянных α -частиц и получил заряды ядер атомов меди, серебра и платины (см. таблицу 2.1). Данные Чедвига не оставляют сомнений в справедливости закона Мозли. Помимо указанных элементов в экспериментах были определены также заряды ядер магния, алюминия, аргона и золота.
Таблица 2.1. Результаты опытов Чедвика
Определения. После открытия Мозли стало ясно, что основной характеристикой атома является заряд ядра, а не его атомная масса, как это предполагали химики 19 века, ибо заряд ядра определяет число атомных электронов, а значит, химические свойства атомов. Причина различия атомов химических элементов как раз и состоит в том, что их ядра имеют разное число протонов в своем составе. Напротив, разное число нейтронов в ядрах атомов при одинаковом числе протонов никак не меняет химические свойства атомов. Атомы, различающиеся только числом нейтронов в ядрах, называются изотопами химического элемента.
Атом с определенным числом протонов и нейтронов в составе ядра называется нуклидом. Состав ядра задается числами Z и A . Об изотопе говорят только имея ввиду принадлежность к химическому элементу, например, 235 U есть изотоп урана, но 235 U – делящийся нуклид, а не делящийся изотоп.
Атомы, ядра которых содержат одинаковое число нейтронов, но разное число протонов, называются изотонами. Атомы с одинаковыми массовыми числами, но различным протон-нейтронным составом ядер, называются изобарами.
Атом химического элемента состоит из ядра
И электронной оболочки. Ядро - это центральная часть атома, в котором сосредоточена почти вся его масса. В отличие от электронной оболочки, ядро имеет положительный заряд .
Вам понадобится
- Атомный номер химического элемента, закон Мозли
Инструкция
Ядро атома состоит из двух типов частиц - протонов и нейтронов. Нейтроны являются электронейтральными частицами, то есть их электрический заряд равен нуля. Протоны являются положительно заряженными частицами и их электрический заряд равен +1.
Таким образом, заряд ядра равен количеству протонов. В свою очередь, количество протонов в ядре равно атомному номеру химического элемента. К примеру, атомный номер водорода - 1, то есть ядро водорода состоит из одного протона имеет заряд +1. Атомный номер натрия - 11, заряд его ядра равен +11.
При альфа-распаде ядра
его его атомный номер уменьшается на два за счет испускания альфа-частицы (ядра
атома гелия). Таким образом, количество протонов в ядре, испытавшем альфа-распад, также уменьшается на два.
Бета-распад может происходить в трех различных видах. В случае распада «бета-минус» нейтрон превращается в протон при испускании электрона и антинейтрино. Тогда заряд
ядра
увеличивается на единицу.
В случае распада «бета-плюс» протон превращается в нейтрон, позитрон и нйтрино, заряд
ядра
уменьшается на единицу.
В случае электронного захвата заряд
ядра
также уменьшается на единицу.
Заряд ядра
можно также определить по частоте спектральных линий характеристического излучения атома. Согласно закону Мозли: sqrt(v/R) = (Z-S)/n, где v - спектральная частота характеристического излучения, R - постоянная Ридберга, S - постоянная экранирования, n - главное квантовое число.
Таким образом, Z = n*sqrt(v/r)+s.
Атомы любых веществ являются электрически нейтральными частицами. Атом состоит из ядра и совокупности электронов. Ядро несет положительный заряд, суммарный заряд которого равен сумме зарядов всех электронов атома.
Общие сведения о заряде ядра атома
Заряд ядра атома определяет местоположение элемента в периодической системе Д.И. Менделеева и соответственно химические свойства вещества, состоящего их этих атомов и соединений этих веществ. Величина заряда ядра равна:
где Z - номер элемента в таблице Менделеева, e - величина заряда электрона или .
Элементы с одинаковыми числами Z, но разными атомными массами называют изотопами. Если элементы имеют одинаковые Z, то у них ядро имеет равное число протонов, а если атомные массы различны, то число нейтронов в ядрах этих атомов разное. Так, у водорода имеется два изотопа: дейтерий и тритий.
Ядра атомов имеют положительный заряд, так как состоят из протонов и нейтронов. Протоном называют стабильную частицу, принадлежащую классу адронов, являющуюся ядром атома водорода. Протон - это положительно заряженная частица. Ее заряд равен по модулю элементарному заряду, то есть величине заряда электрона. Заряд протона часто обозначают как , тогда можно записать, что:
Масса покоя протона () примерно равна:
Подробнее о протоне можно узнать, прочитав раздел «Заряд протона».
Эксперименты по измерению заряда ядра
Первым заряды ядер измерил Мозли в 1913 г. Измерения были косвенными. Ученый определил связь между частотой рентгеновского излучения () и зарядом ядра Z.
где C и B - постоянные не зависящие от элемента для рассматриваемой серии излучения.
Напрямую заряд ядра измерил Чедвик в 1920 г. Он проводил рассеивание - частиц на металлических пленках, по сути, повторяя опыты Резерфорда, которые привели Резерфорда к построению ядерной модели атома.
В этих экспериментах - частицы пропускались через тонкую металлическую фольгу. Резерфорд выяснил, что в большинстве случаев частицы проходили сквозь фольгу, отклоняясь на малые углы от первоначального направления движения. Это объясняется тем, что - частицы отклоняются под воздействием электрических сил электронов, которые имеют значительно меньшую массу, чем - частицы. Иногда, довольно редко - частицы отклонялись на углы превышающие 90 o . Этот факт Резерфорд объяснил наличием в атоме заряда, который локализован в малом объеме, и этот заряд связан с массой, которая много больше, чем у - частицы.
Для математического описания результатов своих экспериментов Резерфорд вывел формулу, которая определяет угловое распределение - частиц после их рассеяния атомами. При выводе этой формулы ученый использовал закон Кулона для точечных зарядов и при этом считал, что масса ядра атома много больше, чем масса - частицы. Формулу Резерфорда можно записать как:
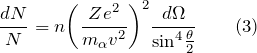
где n - количество рассеивающих ядер на единицу площади фольги; N - число - частиц, которые проходят за 1 секунду через единичную площадку, перпендикулярно к направлению потока - частиц; - количество частиц, которые рассеиваются внутри телесного угла - заряд центра рассеяния; - масса - частицы; - угол отклонения - частиц; v - скорость - частицы.
Формулу Резерфорда (3) можно использовать для того, чтобы найти заряд ядра атома (Z), если провести сравнение числа падающих - частиц (N) с числом (dN) частиц рассеянных под углом , то функция будет зависеть только от заряда рассеивающего ядра. Проводя опыты и применяя формулу Резерфорда Чедвик нашел заряды ядер платины, серебра и меди.
Примеры решения задач
ПРИМЕР 1
| Задание | Пластину из металла облучают - частицами, имеющими большую скорость. Некоторая часть этих частиц при упругом взаимодействии с ядрами атомов металла изменяет направление своего движения на противоположное. Каков заряд ядра атомов металла (q), если минимальное расстояние сближения частицы и ядра равно r. Масса - частицы равна ее скорость v. При решении задачи релятивистскими эффектами можно пренебречь. Частицы считать точечными, ядро неподвижным и точечным. |
| Решение | Сделаем рисунок.
Двигаясь в направлении ядра атома - частица преодолевает силу Кулона, отталкивающую ее от ядра, так как частица и ядро имеют положительные заряды. Кинетическая энергия движущейся - частицы переходит в потенциальную энергию взаимодействия ядра атома металла и - частицы. За основу решения задачи следует принять закон сохранения энергии.: Потенциальную энергию точечных заряженных частиц найдем как:
где заряд - частицы равен: , так как и - частиц - это ядро атома гелия, которое состоит из двух протонов и двух нейтронов, , так как будем считать, что эксперимент проводят в воздухе. Кинетическая энергия - частицы до соударения с ядром атома равна:
В соответствии с (1.1) приравняем правые части выражений (1.2) и (1.3), имеем:
Из формулы (1.4) выразим заряд ядра:
|
| Ответ |