Опыт Резерфорда • Джеймс Трефил, энциклопедия «Двести законов мироздания. Строение атома. Опыты Резерфорда
Корпускулярно-волновой дуализм свойств света.
Подведем итоги раздела «Оптика».
В рамках геометрической оптики природа света не рассматривается. Используется понятие светового луча, для которого формулируются законы геометрической оптики. Эти законы позволяют рассчитывать траекторию движения световых лучей в случае, когда размеры различных препятствий на пути луча достаточно большие. Использование этих законов позволило создавать различные оптические системы и приборы (линза, микроскоп, телескоп, фотоаппарат, диапроектор).
Рассматривая свет как электромагнитную волну, удалось понять такие явления как интерференция, дифракция, поляризация света. Волновая природа света проявляет себя, когда размеры препятствия на пути световой волны сравнимы с длиной волны. Явления интерференции, дифракции, поляризации света находят разнообразное практическое применение (спектрометрия, дефектоскопия, голография).Волновые свойства света необходимо учитывать при конструировании различных оптических систем.
В квантовой оптике свет проявляет себя как поток частиц или квантов света – фотонов. В рамках квантовых представлений находят объяснения такие явления как тепловое излучение тел, внешний и внутренний фотоэффект, эффект Комптона и др.
Тот факт, что свет в одних опытах обнаруживает волновые свойства, а в других – корпускулярные, означает, что он имеет сложную двойственную природу, которую принято характеризовать термином корпускулярно-волновой дуализм . Впоследствии было установлено существование корпускулярно-волнового дуализма частиц вещества.
Г.Я.Мякишев, Б.Б.Буховцев, В.М.Чаругин. Физика. 11 класс. Учебник для общеобразовательных учреждений.- М.: «Просвещение», 2009 и др. Глава 11.
Тема 18. (2 часа)
Атомная физика. Опыты Резерфорда. Планетарная модель атома. Квантовые постулаты Бора. Лазеры.
Открытие сложного строения атома – важнейший этап становления современной физики, наложивший отпечаток на все ее дальнейшее развитие. В процессе создания количественной теории строения атома возникла атомная физика, позволившая объяснить атомные спектры, физические и химические свойства различных веществ, давшая начало другим разделам физики. Были открыты законы движения микрочастиц – законы квантовой механики.
Одну из первых моделей строения атома предложил в 1903 г. Дж. Дж. Томсон . Он предположил, что атом имеет форму шара; положительный заряд распределен равномерно по всему объему этого шара, а отрицательно заряженные электроны находятся внутри него. Радиус атома равен примерно 10 -10 м. Однако экспериментальные результаты доказали ошибочность такой модели.
Опыты Резерфорда . Новая модель атома была предложена Резерфордом в результате проделанных опытов по изучению рассеяния быстрых α -частиц на атомах вещества. В этих опытах в свинцовый контейнер 1 помещался радиоактивный препарат 2 (радий, рис.18.1).Узкий пучок 3 α -частиц (полностью ионизированных атомов гелия, испускаемых радием) направлялся на тонкую металлическую фольгу 4. За ней помещался экран 5, покрытый слоем кристаллов сульфида цинка, способных светиться под ударами быстрых заряженных частиц. Вспышки на экране наблюдались Рис.18.1
с помощью микроскопа 6.
Обнаружено, что α -частицы проникают через тонкие металлические пластины почти без отклонения от прямолинейного пути. Вместе с тем небольшая часть альфа-частиц испытывала отклонение на значительно большие (до 180 ○) углы.
Резерфорд предположил, что рассеяние альфа-частиц на большие углы объясняется тем, что положительный заряд в атоме не распределен равномерно в шаре радиусом 10 -10 м, а сосредоточен в центральной части атома в области значительно меньших размеров.
В этой центральной положительно заряженной части атома – атомном ядре, сосредоточена почти вся масса атома. Расчеты Резерфорда показали, что для объяснения опытов по рассеянию альфа-частиц нужно принять радиус ядра равным примерно 10 -15 м. При таком малом радиусе напряженность электрического поля ядра вблизи его поверхности очень велика. В этом поле на движущуюся α -частицу действует большая сила, которая и отклоняет частицу на большие углы, в том числе и в обратном направлении.
После обнаружения в опытах Резерфорда положительно заряженного ядра необходимо было ответить на вопросы о том, где же в атоме находятся электроны и чем занято в нем остальное пространство. Резерфорд предположил, что атом устроен подобно планетной системе. Как вокруг Солнца на больших расстояниях от него обращаются планеты, так вокруг ядерного ядра в атоме обращаются электроны. Радиус орбиты самого удаленного от ядра электрона и есть радиус атома. Такая модель строения атома была названа планетарной или ядерной моделью.
Однако атомные системы отличаются от планетарных систем физической природой сил, удерживающих планеты и электроны на их орбитах: планеты притягиваются к звездам силами всемирного тяготения, а во взаимодействии электронов с атомным ядром основную роль играют силы кулоновского притяжения разноименных электрических зарядов. Силы гравитационного притяжения между электроном и атомным ядром ничтожно малы по сравнению с электромагнитными.
Ядерная модель атома хорошо объясняет основные закономерности рассеяния заряженных частиц. Так как большая часть пространства между атомным ядром и обращающимися вокруг него электронами пуста, то быстрые заряженные частицы могут почти свободно проникать через слои вещества, содержащие несколько тысяч слоев атомов.
При столкновении с электроном альфа-частица практически не рассеивается, так как ее масса примерно в 8000 раз больше массы электрона. Однако в том случае, когда альфа-частица пролетает вблизи одного из атомных ядер, под действием электрического поля атомного ядра может произойти ее рассеяние на любой угол до 180°. Но из-за малых размеров ядра по сравнению с размерами атома такие события происходят весьма редко.
Ядерная модель атома позволила объяснить результаты опытов по рассеянию альфа-частиц в веществе, но встретилась с другой принципиальной трудностью: законы движения электронов в атоме Резерфорда противоречили законам электродинамики.
Как известно, любое ускоренное движение электрических зарядов сопровождается излучением электромагнитных волн. Движение по окружности является ускоренным движением, поэтому электрон в атоме, должен излучать электромагнитные волны с частотой, равной частоте обращения вокруг ядра. Это должно приводить к уменьшению энергии электрона, постепенному его приближению к атомному ядру и падению на ядро.
Таким образом, атом, состоящий из атомного ядра и обращающихся вокруг него электронов, согласно законам классической физики, неустойчив. Но в действительности атомы устойчивы и в невозбужденном состоянии не излучают свет.
РЕЗЕРФОРД Эрнст (1871-1937), английский физик, один из создателей учения о радиоактивности и строении атома, основатель научной школы, иностранный член-корреспондент РАН (1922) и почетный член АН СССР (1925). Директор Кавендишской лаборатории (с 1919). Открыл (1899) альфа- и бета-лучи и установил их природу. Создал (1903, совместно с Ф. Содди) теорию радиоактивности. Предложил (1911) планетарную модель атома. Осуществил (1919) первую искусственную ядерную реакцию. Предсказал (1921) существование нейтрона. Нобелевская премия (1908).
Опыт Резерфорда (1906 г.) по рассеянию быстрых заряженных частиц при прохождении через тонкие слои вещества позволили исследовать внутреннюю структуру атомов. В этих опытах для зондирования атомов использовались α – частица – полностью ионизированные атомы гелия, - возникающие при радиоактивном распаде радия и некоторых других элементов. Этими частицами Резерфорд бомбардировал атомы тяжелых металлов.
Резерфорду было известно, что атомы состоят из легких отрицательно заряженных частиц – электронов и тяжелой положительно заряженной частицы. Основная цель опытов – выяснить, как распределен положительный заряд внутри атома. Рассеяние α – частиц (то есть изменение направления движения) может вызвать только положительно заряженная часть атома.
Опыты показали, что некоторая часть α – частиц рассеивается на большие углы, близки к 180˚, то есть отбрасывается назад. Это возможно только в том случае, если положительный заряд атома сосредоточен в очень малой центральной части атома – атомном ядре. В ядре сосредоточена также почти вся масса атома.
Оказалось, что ядра различных атомов имеют диаметры порядка 10 -14 – 10 -15 см, в то время как размер самого атома ≈10 -8 см, то есть в 10 4 – 10 5 раз превышает размер ядра.
Таким образом, атом оказался «пустым».
На основании опытов по рассеянию α – частиц на ядрах атомов Резерфорд пришел к планетарной модели атома. Согласно этой модели атом состоит из небольшого положительно заряженного ядра и обращающихся вокруг него электронов.
С точки зрения классической физики такой атом должен быть неустойчив, так как электроны движущиеся по орбитам с ускорением, должны непрерывно излучать электромагнитную энергию.
Дальнейшее развитие представлений о строении атомов было сделано Н. Бором (1913 г.) на основе квантовых представлений.
Данный опыт возможно провести при помощи специального прибора, чертеж которого изображен на рисунке 1. Этот прибор представляет собой свинцовую коробочку с полным вакуумом внутри её и микроскопом.
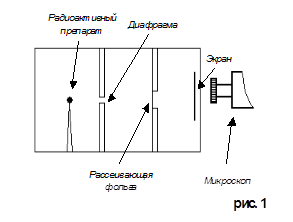
Рассеяние (изменение направления движения) α – частиц может вызвать только положительно заряженная часть атома. Таким образом, по рассеянию α – частиц можно определить характер распределения положительного заряда и массы внутри атома. Схема опытов Резерфорда показана на рисунке 1. Испускаемый радиоактивным препаратом пучок α – частиц выделялся диафрагмой и после этого падал на тонкую фольгу из исследуемого материала (в данном случае это золото). После рассеяния α – частицы попадали на экран, покрытый сернистым цинком. Столкновение каждой частицы с экраном сопровождалось вспышкой света (сцинтилляцией), которую можно было наблюдать в микроскоп.
При хорошем вакууме внутри прибора в отсутствие фольги на экране возникала полоска света, состоящая из сцинтилляций, вызванных тонким пучком α – частиц. Но когда на пути пучка помещалась фольга, α – частицы из-за рассеяния распределялись на большей площади экрана.
В нашем опыте нужно исследовать α – частицу, которая направлена на ядро золота при составлении угла 180° (рис. 2) и проследить за реакцией α – частицы, т.е. на какое минимальное расстояние α – частица приблизится к ядру золота (рис. 3).
 Рис. 2
Рис. 2
 Рис.3
Рис.3
V 0 =1,6*10 7 м / с – начальная скорость
Какое минимальное расстояние r min между α – частицей и ядром удастся реализовать в данном эксперименте? (Рис. 4)
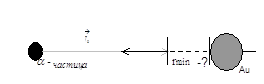 Рис.4
Рис.4
В нашем эксперименте α – частица представлена как атом
![]() m нейтр кг
m нейтр кг
Z=2 – протонов
N = Au – Z = 4 – 2 = 2 нейтрона
![]()
Z=79 – число протонов
N = Au – Z = 196 – 79 =117 (нейтронов)
![]()
![]()
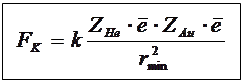
![]()
![]() Кл 2 /H ∙м 2 – электрическая постоянная
Кл 2 /H ∙м 2 – электрическая постоянная
![]() m 2 =6,6∙10 -27 кг
m 2 =6,6∙10 -27 кг
Z He ∙2∙ - заряд ядра (He) Z Au ∙- заряд ядра (Au)
Заряд α-частицы равен 2 элементарным.
Ответ: r min =4,3·10 -14 м
Вывод: При этом опыте удалось выяснить, что a-частица смогла приблизится к ядру атома на минимальное расстояние, которое составило r min =4,3·10 -14 м и возвратится обратно, по той же траектории по которой она начинала движение.
Когда этот же опыт Резерфорд проделал в первые, при таком расположении a-частицы по отношению к углу составляющему 180° он удивленно сказал: «Это почти столь же невероятно, как если бы вы выстрелили 15-дюймовым снарядом в кусок тонкой бумаги, а снаряд возвратился бы к вам и нанес вам удар».
И в правду, это не вероятно, дело в том, что проводя этот опыт на меньших углах, то а - частица обязательно отскочит в сторону, подобно тому как камушек несколько десятков граммов при столкновении с автомобилем не в состоянии заметно изменить его скорость (рис. 5). Так как их масса примерно в 8000 раз больше массы электрона, а положительный заряд равен по модулю удвоенному заряду электрона. Это не что иное, как полностью ионизированные атомы гелия. Скорость α – частиц очень велика: она составляет 1 / 15 скорости света. Следовательно, электроны вследствие своей малой массы не могут заметно изменить траекторию α – частицы.
![]() Рис. 5
Рис. 5
Существуют нейтральные микрообъекты (например, фотон, нейтрино, нейтрон). Электрический заряд сложного микрообъекта равен алгебраической сумме зарядов составляющих его частиц. 4. Идея корпускулярно-волнового дуализма как методологический принцип Классическая физика знакомит с двумя видами движения -корпускулярным и волновым. Для первого характерны локализация объекта в пространстве и...
Телепередача из печени и др. Любопытные эффекты и остроумные решения: радиоактивность человека, радиоактивный сыр, восстановление пропавших изображений на фотографиях, автографы невидимок. Методы поиска и исследований в преподавании физики Введение От мифов к простым фактам. Потребность в познании мира в начале привела к попыткам объяснить мир сразу в целом, немедленно получить ответы на...
А. Опыты Резерфорда
В 1911 г. Резерфорд провел исключительные по своему значению эксперименты, доказавшие существование ядра атома. Для исследования атома Резерфорд применил его зондирование (бомбардировку) с помощью α-частиц, которые возникают при распаде радия, полония и некоторых других элементов. Резерфордом и его сотрудниками еще в более ранних опытах в 1909 г. было установлено, что α-частицы обладают положительным зарядом, равным по модулю удвоенному заряду электрона q =+2e, и массой, совпадающей c массой атома гелия, то есть
m а = 6,62 · 10 -27 кг,
что примерно в 7300 раз больше массы электрона. Позже было установлено, что α-частицы представляют собой ядра атомов гелия. Этими частицами Резерфорд бомбардировал атомы тяжелых элементов. Электроны вследствие своей малой массы не могут изменить траекторию α-частαицы. Их рассеяние (изменение направления движения) может вызвать только положительно заряженная часть атома. Таким образом, по рассеянию α-частиц можно определить характер распределения положительного заряда, а значит, и массы внутри атома.
Было известно, что α-частицы, излученные полонием, летят со скоростью 1,6-107 м/с. Полоний помещался внутрь свинцового футляра, вдоль которого высверлен узкий канал. Пучок α-частиц, пройдя канал и диафрагму, падал на фольгу. Золотую фольгу можно сделать исключительно тонкой – толщиной 4-10 -7 м (в 400 атомов золота; это число можно оценить, зная массу, плотность и молярную массу золота). После фольги α-частицы попадали на полупрозрачный экран, покрытый сульфидом цинка. Столкновение каждой частицы с экраном сопровождалось вспышкой света (сцинтилляцией), обусловленной флуресценцией, которая наблюдалась в микроскоп.
При хорошем вакууме внутри прибора (чтобы не было рассеяния частиц от молекул воздуха) в отсутствие фольги на экране возникал светлый кружок из сцинтилляций, вызываемых тонким пучком α-частиц. Когда на пути пучка помещалась фольга, то подавляющее большинство α-частиц все равно не отклонялось от своего первоначального направления, то есть проходило сквозь фольгу, как если бы она представляла собой пустое пространство. Однако имелись α-частицы, которые изменяли свой путь и даже отскакивали назад.
Марсден и Гейгер, ученики и сотрудники Резерфорда, насчитали более миллиона сцинтилляций и определили, что примерно одна из 2 тысяч α-частиц отклонялась на углы, большие 90°, а одна из 8 тысяч – на 180°. Объяснить этот результат на основе других моделей атома, в частности Томсона, было нельзя.
Расчеты показывают, что при распределении по всему атому положительный заряд (даже без учета электронов) не может создать достаточно интенсивное электрическое поле, способное отбросить α-части-цу назад. Напряженность электрического поля равномерно заряженного шара максимальна на поверхности шара и убывает до нуля по мере приближения к центру. Рассеяние α-частиц на большие углы происходит так, как если бы весь положительный заряд атома был сосредоточен в его ядре – области, занимающей весьма малый объем по сравнению со всем объемом атома.
Вероятность попадания α-частиц в ядро и их отклонение на большие углы очень мала, поэтому для большинства α-частиц фольги как бы не существовало.
Резерфорд теоретически рассмотрел задачу о рассеянии α-частиц в кулоновском электрическом поле ядра и получил формулу, позволяющую по плотности потока α-частиц, налетающих на ядро, и измеренному числу частиц, рассеянных под некоторым углом, определить число N элементарных положительных зарядов +е, содержащихся в ядре атомов данной рассеивающей фольги. Опыты показали, что число N равно порядковому номеру элемента в периодической системе Д. И. Менделеева, то есть N = Z (для золота Z = 79).
Таким образом, гипотеза Резерфорда о сосредоточении положительного заряда в ядре атома позволила установить физический смысл порядкового номера элемента в периодической системе элементов. В нейтральном атоме должно содержаться также Z электронов. Существенно, что число электронов в атоме, определенное различными методами, совпало с числом элементарных положительных зарядов в ядре. Это послужило проверкой справедливости ядерной модели атома.
Б. Ядерная модель атома Резерфорда
Обобщая результаты опытов по рассеянию α-частиц золотой фольгой, Резерфорд установил:
♦ атомы по своей природе в значительной мере прозрачны для α-частиц;
♦ отклонения α-частиц на большие углы возможны только в том случае, если внутри атома имеется очень сильное электрическое поле, создаваемое положительным зарядом, связанным с большой и сконцентрированной в очень малом объеме массой.
Для объяснения этих опытов Резерфорд предложил ядерную модель атома: в ядре атома (области с линейными размерами 10 -15 -10 -14 м) сосредоточены весь его положительный заряд и практически вся масса атома (99,9 %). Вокруг ядра в области с линейными размерами ~10 -10 м (размеры атома оценены в молекулярно-кинетической теории) движутся по замкнутым орбитам отрицательно заряженные электроны, масса которых составляет лишь 0,1 % массы ядра. Следовательно, электроны находятся от ядра на расстоянии от 10 000 до 100 000 поперечников ядра, то есть основную часть атома составляет пустое пространство.
Ядерная модель атомов Резерфорда напоминает солнечную систему: в центре системы находится «солнце» – ядро, а вокруг него по орбитам движутся «планеты» – электроны, поэтому данную модель называют планетарной. Электроны не падают на ядро потому, что электрические силы притяжения между ядром и электронами уравновешиваются центробежными силами, обусловленными вращением электронов вокруг ядра.
В 1914 г., через три года после создания планетарной модели атома, Резерфорд исследовал положительные заряды в ядре. Бомбардируя электронами атомы водорода, он обнаружил, что нейтральные атомы превратились в положительно заряженные частицы. Так как атом водорода имеет один электрон, Резерфорд решил, что ядро атома является частицей, несущей элементарный положительный заряд +е. Эту частицу он назвал протоном.
Планетарная модель хорошо согласуется с опытами по рассеиванию α-частиц, но она не может объяснить устойчивость атома. Рассмотрим, например, модель атома водорода, содержащего ядро-протон и один электрон, который движется со скоростью v вокруг ядра по круговой орбите радиуса r. Электрон должен по спирали падать на ядро, и частота его обращения вокруг ядра (следовательно, и частота излучаемых им электромагнитных волн) должна непрерывно изменяться, то есть атом неустойчив, и его электромагнитное излучение должно иметь непрерывный спектр.
В действительности оказывается, что:
а) атом устойчив;
б) атом излучает энергию лишь при определенных условиях;
в) излучение атома имеет линейчатый спектр, определяемый его строением.
Таким образом, применение классической электродинамики к планетарной модели атома привело к полному противоречию с экспериментальными фактами. Преодоление возникших трудностей потребовало создания качественно новой – квантовой – теории атома. Однако, несмотря на свою несостоятельность, планетарная модель и сейчас принята в качестве приближенной и упрощенной картины атома.
α-частицы – это полностью ионизированные атомы гелия. Они были открыты Резерфордом в 1899 году при изучении явления радиоактивности. Этими частицами Резерфорд бомбардировал атомы тяжелых элементов (золото, серебро, медь и др.). Электроны, входящие в состав атомов, вследствие малой массы не могут заметно изменить траекторию α-частицы. Рассеяние, то есть изменение направления движения α-частиц, может вызвать только тяжелая положительно заряженная часть атома.
От радиоактивного источника, заключенного в свинцовый контейнер, α-частицы направлялись на тонкую металлическую фольгу. Рассеянные частицы попадали на экран, покрытый слоем кристаллов сульфида цинка, способных светиться под ударами быстрых заряженных частиц. Сцинтилляции (вспышки) на экране наблюдались глазом с помощью микроскопа. Наблюдения рассеянных α-частиц в опыте Резерфорда можно было проводить под различными углами φ к первоначальному направлению пучка. Было обнаружено, что большинство α-частиц проходит через тонкий слой металла, практически не испытывая отклонения. Однако небольшая часть частиц отклоняется на значительные углы, превышающие 30°. Очень редкие α-частицы (приблизительно одна на десять тысяч) испытывали отклонение на углы, близкие к 180°.
Эти соображения привели Резерфорда к выводу, что атом почти пустой, и весь его положительный заряд сосредоточен в малом объеме. Эту часть атома Резерфорд назвал атомным ядром. Так возникла ядерная модель атома.
Таким образом, опыты Резерфорда и его сотрудников привели к выводу, что в центре атома находится плотное положительно заряженное ядро, диаметр которого не превышает 10 –14 –10 –15 м. Это ядро занимает только 10 –12 часть полного объема атома, но содержит весь положительный заряд и не менее 99,95 % его массы. Веществу, составляющему ядро атома, следовало приписать колоссальную плотность порядка ρ ≈ 10 15 г/см 3 . Заряд ядра должен быть равен суммарному заряду всех электронов, входящих в состав атома. Впоследствии удалось установить, что если заряд электрона принять за единицу, то заряд ядра в точности равен номеру данного элемента в таблице Менделеева.
Радикальные выводы о строении атома, следовавшие из опытов Резерфорда, заставляли многих ученых сомневаться в их справедливости. Не был исключением и сам Резерфорд, опубликовавший результаты своих исследований только в 1911 г. через два года после выполнения первых экспериментов. Опираясь на классические представления о движении микрочастиц, Резерфорд предложил планетарную модель атома. Согласно этой модели, в центре атома располагается положительно заряженное ядро, в котором сосредоточена почти вся масса атома. Атом в целом нейтрален. Вокруг ядра, подобно планетам, под действием кулоновских сил со стороны ядра вращаются электроны (рис. 6.1.4). Находиться в состоянии покоя электроны не могут, так как они упали бы на ядро.
Опыт Резерфорда.
РЕЗЕРФОРД Эрнст (1871-1937), английский физик, один из создателей учения о радиоактивности и строении атома, основатель научной школы, иностранный член-корреспондент РАН (1922) и почетный член АН СССР (1925). Директор Кавендишской лаборатории (с 1919). Открыл (1899) альфа- и бета-лучи и установил их природу. Создал (1903, совместно с Ф. Содди) теорию радиоактивности. Предложил (1911) планетарную модель атома. Осуществил (1919) первую искусственную ядерную реакцию. Предсказал (1921) существование нейтрона. Нобелевская премия (1908).Опыт Резерфорда (1906 г.) по рассеянию быстрых заряженных частиц при прохождении через тонкие слои вещества позволили исследовать внутреннюю структуру атомов. В этих опытах для зондирования атомов использовались α – частица – полностью ионизированные атомы гелия, - возникающие при радиоактивном распаде радия и некоторых других элементов. Этими частицами Резерфорд бомбардировал атомы тяжелых металлов.
Резерфорду было известно, что атомы состоят из легких отрицательно заряженных частиц – электронов и тяжелой положительно заряженной частицы. Основная цель опытов – выяснить, как распределен положительный заряд внутри атома. Рассеяние α – частиц (то есть изменение направления движения) может вызвать только положительно заряженная часть атома.
Опыты показали, что некоторая часть α – частиц рассеивается на большие углы, близки к 180˚, то есть отбрасывается назад. Это возможно только в том случае, если положительный заряд атома сосредоточен в очень малой центральной части атома – атомном ядре. В ядре сосредоточена также почти вся масса атома.
Оказалось, что ядра различных атомов имеют диаметры порядка 10 -14 – 10 -15 см, в то время как размер самого атома ≈10 -8 см, то есть в 10 4 – 10 5 раз превышает размер ядра.
Таким образом, атом оказался «пустым».
На основании опытов по рассеянию α – частиц на ядрах атомов Резерфорд пришел к планетарной модели атома . Согласно этой модели атом состоит из небольшого положительно заряженного ядра и обращающихся вокруг него электронов.
С точки зрения классической физики такой атом должен быть неустойчив, так как электроны движущиеся по орбитам с ускорением, должны непрерывно излучать электромагнитную энергию.
Дальнейшее развитие представлений о строении атомов было сделано Н. Бором (1913 г.) на основе квантовых представлений.
Лабораторная работа.
Данный опыт возможно провести при помощи специального прибора, чертеж которого изображен на рисунке 1. Этот прибор представляет собой свинцовую коробочку с полным вакуумом внутри её и микроскопом.
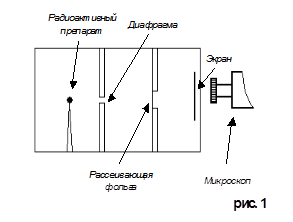
Рассеяние (изменение направления движения) α – частиц может вызвать только положительно заряженная часть атома. Таким образом, по рассеянию α – частиц можно определить характер распределения положительного заряда и массы внутри атома. Схема опытов Резерфорда показана на рисунке 1. Испускаемый радиоактивным препаратом пучок α – частиц выделялся диафрагмой и после этого падал на тонкую фольгу из исследуемого материала (в данном случае это золото). После рассеяния α – частицы попадали на экран, покрытый сернистым цинком. Столкновение каждой частицы с экраном сопровождалось вспышкой света (сцинтилляцией), которую можно было наблюдать в микроскоп.
При хорошем вакууме внутри прибора в отсутствие фольги на экране возникала полоска света, состоящая из сцинтилляций, вызванных тонким пучком α – частиц. Но когда на пути пучка помещалась фольга, α – частицы из-за рассеяния распределялись на большей площади экрана.
В нашем опыте нужно исследовать α – частицу, которая направлена на ядро золота при составлении угла 180° (рис. 2) и проследить за реакцией α – частицы, т.е. на какое минимальное расстояние α – частица приблизится к ядру золота (рис. 3).
 Рис. 2
Рис. 2
 Рис.3
Рис.3
Дано:
V 0 =1,6*10 7 м / с – начальная скорость
d = 10 -13
r min =?
Вопрс:
Какое минимальное расстояние r min между α – частицей и ядром удастся реализовать в данном эксперименте? (Рис. 4)
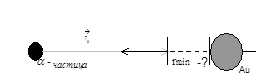 Рис.4
Рис.4
Решение:
В нашем эксперименте α – частица представлена как атом
Z=2 – протонов
N = Au – Z = 4 – 2 = 2 нейтрона
m p = кг
Z=79 – число протонов
N = Au – Z = 196 – 79 =117 (нейтронов)
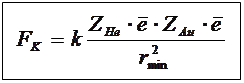
![]()
![]() Кл 2
/
H ∙м 2
– электрическая постоянная
Кл 2
/
H ∙м 2
– электрическая постоянная



