Мир прекрасен. Основные сведения о строении атома: характеристики, особенности и формула
Плазме).
Свойства атома, в том числе важнейшая
для способность атома образовывать химические соединения, определяются особенностями его строения.
Общая характеристика строения атома. Атом состоит из положительно заряженного
ядра, окруженного облаком отрицательно заряженных электронов. Размеры атома
в целом определяются размерами его электронного облака и велики по сравнению
с размерами ядра (линейные размеры атома ~ 10~ 8 см, его ядра
~ 10" -10" 13 см). Электронное облако атома не имеет строго определенных
границ, поэтому размеры атома в значительной степени условны и зависят от способов
их определения. Ядро атома состоит из Z протонов
и N
нейтронов, удерживаемых ядерными силами. Положит. заряд протона и отрицат. заряд электрона одинаковы по абсолютной
величине и равны е= 1,60*10 -19 Кл; нейтрон не обладает электрическим
зарядом. Заряд ядра +Ze - основная характеристика атома, обусловливающая его принадлежность
к определенному химическому элементу. Порядковый номер элемента в периодической системе
Менделеева (атомный номер) равен числу в ядре.
В электрически нейтральном атоме число в облаке равно числу
протонов в ядре. Однако при определенных условиях он может терять или присоединять
электроны, превращаясь соответственно в положительный или отрицательный . например Li + ,
Li 2+ или О - , О 2- . Говоря об атомах определенного
элемента, подразумевают как нейтральные атомы, так и этого элемента.
Масса атома определяется массой его ядра; масса электрона (9,109*10 -28
г) примерно в 1840 раз меньше массы протона или нейтрона (
1,67*10 -24 г), поэтому вклад в массу атома незначителен.
Общее число и А = Z + N
наз. .
Массовое число и заряд ядра указываются соответственно верхним и нижним индексами
слева от символа элемента, например 23 11 Na. Вид атомов
одного элемента с определенным значением N
называют . Атомы одного
и того же элемента с одинаковыми Z и разными N
наз. этого
элемента Различие масс изотопов мало сказывается на их химических и физических свойствах.
Наиболее значительные, отличия наблюдаются у изотопов
водорода вследствие большой относительной разницы в массах обычного
(протия), D
и Т .
Точные значения масс атомов определяют методами масс-спектрометрии.
Атома. Благодаря малым размерам и большой массе ядро атома можно приближенно считать точечным и покоящимся в центре масс атома, и рассматривать атом, как систему электронов, движущихся вокруг неподвижного центра - ядра. Полная энергия такой системы Е равна сумме кинетических энергий Т всех и потенциальной энергии U, которая складывается из энергии притяжения ядром и энергии взаимного отталкивания электронов друг от друга. Атом подчиняется законам квантовой механики; его основная характеристика как квантовой системы - полная энергия Е - может принимать лишь одно из значений дискретного ряда Е 1 ...; промежут. значениями энергии атом обладать не может. Каждому из "разрешенных" значений Е соответствует одно или несколько стационарных (с не изменяющейся во времени энергией) состояний атома Энергия Е может изменяться только скачкообразно - путем квантового перехода атома из одного стационарного состояния в другое. Методами квантовой механики можно точно рассчитать Е для одноэлектронных атомов - водорода и водородоподобных: Е= -hcRZ 2 /n 2 , где h - постоянная Планка, с- скорость света, целое число п = 1, 2, 3, ... определяет дискретные значения энергии и наз. главным квантовым числом; R-постоянная Ридберга (hcR = 13,6 эВ). При использовании СИ формула для выражения дискретных уровней энергии одноэлектронных атомов записывается в виде:
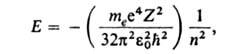
где т е -
масса электрона, -электрическая
постоянная,
Возможные "разрешенные" значения энергии в атоме изображают в виде
схемы уровней энергии - горизонтальных прямых, расстояния между которыми
соответствуют разностям этих значений энергий (рисунок 1). наиболее низкий уровень
E 1 , отвечающий минимально возможной энергии, называют основным,
все остальные - возбужденными. Аналогично называют состояния (основное и возбужденные)
которым соответствуют указанные уровни энергии. С ростом п
уровни
сближаются и при
энергия электрона приближается к значению, отвечающему свободному (покоящемуся)
электрону, удаленному из атома. Квантовое состояние атома с энергией Е
полностью
описывается волновой функцией ,
где r-радиус-вектор электрона ядра Произведение
равно вероятности нахождения электрона в объеме dV,
то есть
- плотность вероятности. Волновая функция
определяется уравнением Шрёдингера = ,
где R-оператор полной энергии (гамильтониан).
Наряду с энергией движение электрона вокруг ядра (орбитальное движение)
характеризуется орбитальным моментом импульса (орбитальным механическим моментом)
М 1 ; квадрат его величины может принимать значения, определяемые
орбитальным квантовым числом l = 0, 1, 2, ...; ![]() , где . При
заданном и квантовое число l может принимать значения от 0 до (и - 1).
Проекция орбитального момента на некоторую ось z также принимает дискретный
ряд значений М lz = ,
где m l -магнитное квантовое число, имеющее дискретные значения
от - l до +l(-l,... - 1, 0, 1, ... + l), всего 2l
+ 1 значений.
Ось z для атома в отсутствие внешних сил выбирается произвольно, а в магнитном поле
совпадает с направлением вектора напряженности поля. Электрон обладает
также собственным моментом импульса -спином
и связанным с ним спиновым
магнитным моментом. Квадрат спинового механического момента М S 2
= S(S
+
+ 1) определяется спиновым квантовым числом S
= 1/2, а проекция
этого момента на ось z M sz = =
-квантовым
числом m s ,
принимающим полуцелые значения m s = 1 / 2
и m s
= - 1 / 2 .
, где . При
заданном и квантовое число l может принимать значения от 0 до (и - 1).
Проекция орбитального момента на некоторую ось z также принимает дискретный
ряд значений М lz = ,
где m l -магнитное квантовое число, имеющее дискретные значения
от - l до +l(-l,... - 1, 0, 1, ... + l), всего 2l
+ 1 значений.
Ось z для атома в отсутствие внешних сил выбирается произвольно, а в магнитном поле
совпадает с направлением вектора напряженности поля. Электрон обладает
также собственным моментом импульса -спином
и связанным с ним спиновым
магнитным моментом. Квадрат спинового механического момента М S 2
= S(S
+
+ 1) определяется спиновым квантовым числом S
= 1/2, а проекция
этого момента на ось z M sz = =
-квантовым
числом m s ,
принимающим полуцелые значения m s = 1 / 2
и m s
= - 1 / 2 .
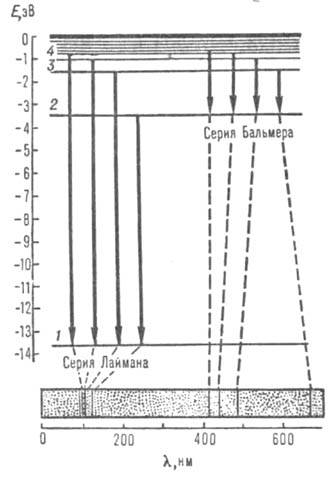
Рис. 1. Схема уровней энергии водорода (горизонтальные линии)
и оптических переходов (вертикальные линии). Внизу изображена часть атомного
спектра испускания водорода - две серии спектральных линий; пунктиром показано
соответствие линий и переходов электрона
Стационарное состояние одноэлектронного атома однозначно характеризуется
четырьмя квантовыми числами: n, l, m l и m s . Энергия
атома водорода зависит только от n
, и уровню с заданным n
соответствует
ряд состояний, отличающихся значениями l, m l , m s .
Состояния с заданными n
и l принято обозначать как 1s, 2s, 2p,
3s
и т.д., где цифры указывают значения k, а буквы s, p, d, f и
дальше по латинскому алфавиту соответствуют значениям l = 0, 1, 2,
3, ... Число различных состояний с заданными n
и l равно 2(2l+ 1) числу
комбинаций значений m l и m s . Общее число разл. состояний
с заданным n
равно 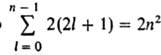 , т. е. уровням со значениями п
= 1, 2, 3, ... соответствуют 2,
8, 18, ..., 2n 2 разл. квантовых состояний. Уровень, которому соответствует
лишь одно квантовое состояние (одна волновая ф-ция), назsdf.n невырожденным.
Если уровню соответствует два или более квантовых состояний, он называется вырожденным.
В атоме водорода уровни энергии
вырождены по значениям l и m l ; вырождение по m s имеет
место лишь приближенно, если не учитывать взаимодействия спинового магнитного момента
электрона с магнитным полем, обусловленным орбитальным движением электрона
в электрическом поле ядра. Это - релятивистский эффект, малый в сравнении с кулоновским взаимодействием, однако
он принципиально существен, так как приводит к дополнительному расщеплению уровней
энергии, что проявляется в атомных спектрах в виде так называемой тонкой структуры.
, т. е. уровням со значениями п
= 1, 2, 3, ... соответствуют 2,
8, 18, ..., 2n 2 разл. квантовых состояний. Уровень, которому соответствует
лишь одно квантовое состояние (одна волновая ф-ция), назsdf.n невырожденным.
Если уровню соответствует два или более квантовых состояний, он называется вырожденным.
В атоме водорода уровни энергии
вырождены по значениям l и m l ; вырождение по m s имеет
место лишь приближенно, если не учитывать взаимодействия спинового магнитного момента
электрона с магнитным полем, обусловленным орбитальным движением электрона
в электрическом поле ядра. Это - релятивистский эффект, малый в сравнении с кулоновским взаимодействием, однако
он принципиально существен, так как приводит к дополнительному расщеплению уровней
энергии, что проявляется в атомных спектрах в виде так называемой тонкой структуры.
При заданных n, l и m l квадрат модуля волновой ф-ции определяет для электронного облака в атоме среднее распределение электронной плотности. Различные квантовые состояния атома водорода существенно отличаются друг от друга распределением электронной плотности (рис. 2). Так, при l = 0 (s-состояния) электронная плотность отлична от нуля в центре атома и не зависит от направления (т.е. сферически симметрична), для остальных состояний она равна нулю в центре атома и зависит от направления.

Рис. 2. Форма электронных облаков для различных состояний водорода
В многоэлектронных атомах вследствие взаимного электростатического отталкивания электронов существенно уменьшается прочность их связи с ядром. Например, энергия отрыва электрона от . Не + равна 54,4 эВ, в нейтральном атоме Не она значительно меньше - 24,6 эВ. Для более тяжелых атомов связь внешних электронов с ядром еще слабее. Важную роль в многоэлектронных атомах играет специфическое обменное взаимодействие , связанное с неразличимостью электронов, и тот факт, что электроны подчиняются принципу Паули, согласно которому в каждом квантовом состоянии, характеризуемом четырьмя квантовыми числами, не может находиться более одного электрона Для многоэлектронного атома имеет смысл говорить только о квантовых состояниях всего атома в целом. Однако приближенно, в так называемом одноэлектронном приближении, можно рассматривать квантовые состояния отдельных и характеризовать каждое одноэлектронное состояние (определенную орбиталъ, описываемую соответствующей функцией) совокупностью четырех квантовых чисел n, l, m l и m s . Совокупность 2(2l+ 1) в состоянии с данными n и l образует электронную оболочку (назsdftve. также подуровнем, подоболочкой); если все эти состояния заняты электронами, оболочка называется заполненной (замкнутой). Совокупность 2n 2 состояний с одним и тем же n, но разными l образует электронный слой (наз. также уровнем, оболочкой). Для n= 1, 2, 3, 4, ... слои обозначают символами К, L, M, N, ... Число электронов в оболочках и слоях при полном заполнении приведены в таблице:
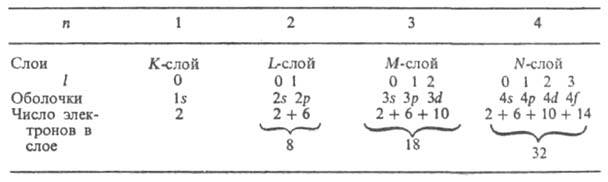
Прочность связи электрона в атоме, то есть, энергия, которую необходимо сообщить электрону, чтобы удалить его из атома, уменьшается с увеличением n, а при данном n - с увеличением l. Порядок заполнения электронами оболочек и слоев в сложном атоме определяет его электронную конфигурацию, то есть распределение электронов по оболочкам в основном (невозбужденном) состоянии этого атома и его . При таком заполнении последовательно связываются электроны с возрастающими значениями и и /. Например, для атома азота (Z = 7) и его N + , N 2+ , N 3+ , N 4+ , N 5+ и N 6+ электронные конфигурации имеют вид соотв.: Is 2 2s 2 2p 3 ; Is 2 2s 2 2p 2 ; Is 2 2s 2 2p; Is 2 2s 2 ; Is 2 2s; Is 2 ; Is (число электронов в каждой оболочке указывается индексом справа сверху). Такие же электронные конфигурации, как и у .в азота, имеют нейтральные атомы элементов с тем же числом электронов: С, В, Be, Li, He, Н (Z = 6, 5, 4, 3, 2, 1). Начиная с n = 4 порядок заполнения оболочек изменяется: электроны с большим n, но меньшим l оказываются связанными прочнее, чем электроны с меньшим n и большим l (правило Клечковского), например 4s-электроны связаны прочнее 3d-электронов, и сперва заполняется оболочка 4s, а затем 3d. При заполнении оболочек 3d, 4d, 5d получаются группы соответствующих переходных элементов; при заполнении 4f- и 5f -оболочек - соотв. лантаноиды и актиноиды. Порядок заполнения обычно соответствует возрастанию суммы квантовых чисел (n + l); при равенстве этих сумм для двух или более оболочек сначала заполняются оболочки с меньшим и. Имеет место след. последовательность заполнения электронных оболочек:

Для каждого периода указаны электронная конфигурация благородного газа,
макс. число электронов, а в последней строке приведены значения n
+
l. Имеются, однако, отступления от этого порядка заполнения.
Между стационарными состояниями в атоме возможны квантовые переходы.
При переходе с более высокого уровня энергии Е i на более
низкий E k атом отдает энергию (E i - E k),
при обратном переходе получает ее. При излучательных переходах атом испускает
или поглощает квант электромагнитного излучения (фотон). Возможны и безызлучательные
переходы, когда атом отдает или получает энергию при взаимодействии с другими частицами,
с которыми он сталкивается (например, в газах) или длительно связан (в молекулах,
жидкостях и твердых телах). В атоммарных газах в результате столкновения
свободного атома с другой частицей он может перейти на другой уровень энергии - испытать
неупругое столкновение; при упругом столкновении изменяется лишь кинетическая
энергия поступательного движения атома, а его полная внутренняя энергия Е
остается
неизменной. Неупругое столкновение свободного атома с быстро движущимся электроном,
отдающим этому атому свою кинетическую энергию, - возбуждение атома электронным ударом
- один из методов определения уровней энергии атома.
Строение и свойства веществ.
Химические свойства определяются строением
внешних электронных оболочек атома, в которых электроны связаны сравнительно слабо
(энергии связи от несколько эВ до неск. десятков эВ). Строение внешних оболочек
атомов химических элементов одной группы (или подгруппы) периодич. системы аналогично,
что и обусловливает сходство химических свойств этих элементов. При увеличении числа
электронов в заполняющейся оболочке их энергия связи, как правило, увеличивается;
наибольшей энергией связи обладают электроны в замкнутой оболочке. Поэтому атомы
с одним или несколькими электронами в частично заполненной внешней оболочке отдают
их в химических реакциях. Атомы, которым не хватает одного или нескольких для
образования замкнутой внешней оболочки, обычно принимают их. Атомы благородных
газов, обладающие замкнутыми внешними оболочками, при обычных условиях не
вступают в химические реакции.
Строение внутренних оболочек атомов, электроны которых связаны гораздо прочнее
(энергия связи 10 2 -10 4 эВ), проявляется лишь при
взаимодействии атомов с быстрыми частицами и фотонами высоких энергий. Такие взаимодействия
определяют характер рентгеновских спектров и рассеяние частиц (электронов,
нейтронов) на атомах. Масса атома определяет
такие его физические свойства, как импульс, кинетическая энергия. От механических и
связанных с ними магнитных и электрических моментов ядра атома зависят некоторые тонкие
физические эффекты (ЯМР, ЯКР, сверхтонкая структура спектральных линий).
Более слабые по сравнению с химической связью электростатические взаимодействия двух
атомов проявляются в их взаимной поляризуемости - смещении относительно
ядер и возникновении поляризационных сил притяжения между атомами. Атом поляризуется и во внешних электрических полях; в результате
уровни энергии смещаются и, что особенно важно, вырожденные уровни расщепляются. Атом может поляризоваться также под действием
электрического поля, волны электромагного излучения; поляризация зависит от частоты
излучения, что обусловливает зависимость от нее показателя преломления
в-ва, связанного с поляризуемостью атома Тесная связь оптических свойств атома с его
электрич. свойствами особенно ярко проявляется в оптических спектрах.
Внешние электроны атома определяют и магнитные свойства вещества. В атоме с заполненными
внешними оболочками его магнитный момент, как и полный момент импульса (механический момент),
равен нулю. Атомы с частично заполненными внешними оболочками обладают, как правило,
постоянными магнитными моментами, отличными от нуля; такие вещества парамагнитны. Во внешнем магнитном поле все уровни энергии атома,
для которых магнитный момент не равен нулю, расщепляются. Все атомы обладают диамагнетизмом, который обусловлен возникновением у них
индуцированного магнитного момента под действием внешнего магнитного поля.
Свойства атома, находящегося в связанном состоянии (например, входящего в состав
молекул), отличаются от свойств свободных атомов, наибольшие изменения претерпевают свойства,
определяемые внешними электронами, принимающими участие в химической связи; свойства,
определяемые электронами внутренних оболочек, могут при этом практически не
изменяться. Некоторые свойства атома могут испытывать изменения, зависящие от симметрии
окружения данного атома. Примером может служить расщепление уровней энергии
атома в кристаллах и комплексных соединениях, которое происходит под действием электрических
полей, создаваемых окружающими или лигандами.
Литература:
Карапетьянц М. X., Дракин С.И., Строение вещества, 3 изд.,
М., 1978; Шлольевский Э. В., Атомная физика, 7 изд., т. 1-2, М., 1984.
М.А. Ельяшевич.
Выберите первую букву в названии статьи:
Рассмотрим зависимость некоторых свойств атомов от строения их электронных оболочек. Остановимся, прежде всего, на закономерностях изменения атомных и ионных радиусов.
Электронные облака не имеют резко очерченных границ. Поэтому понятие о размере атома не является строгим. Но если представить себе атомы в кристаллах простого вещества в виде соприкасающихся друг с другом шаров, то расстояние между центрами соседних шаров (т. е. между ядрами соседних атомов) можно принять равным удвоенному радиусу атома. Так, наименьшее межъядерное расстояние в кристаллах меди равно ; это позволяет считать, что радиус атома меди равен половине этой величины, т. е. .
Зависимость атомных радиусов от заряда ядра атома Z имеет периодический характер. В пределах одного периода с увеличением Z проявляется тенденция к уменьшению размеров атома, что особенно четко наблюдается в коротких периодах (радиусы атомов приведены в нм):
Это объясняется увеличивающимся притяжением электронов внешнего слоя к ядру по мере возрастания его заряда.
С началом застройки нового электронного слоя, более удаленного от ядра, т. е. при переходе к следующему периоду, атомные радиусы возрастают (сравните, например, радиусы атомов фтора и натрия). В результате в пределах подгруппы с возрастанием заряда ядра размеры атомов увеличиваются. Приведем в качестве примера значения атомных радиусов (в нм) элементов некоторых главных подгрупп:

Электроны наружного слоя, наименее прочно связанные с ядром, могут отрываться от атома и присоединяться к другим атомам, входя в состав наружного слоя последних.
Атомы, лишившиеся одного или нескольких электронов, становятся заряженными положительно, так как заряд ядра атома превышает сумму зарядов оставшихся электронов. Наоборот, атомы, присоединившие к себе лишние электроны, заряжаются отрицательно. Образующиеся заряженные частицы называются ионами.
Ионы обозначают теми же символами, что и атомы, указывая справа вверху их заряд: например, положительный трехзарядный ион алюминия обозначают , отрицательный однозарядный ион хлора - .
Потеря атомов электронов приводит к уменьшению его эффективных размеров, а присоединение избыточных электронов - к увеличению. Поэтому радиус положительно заряженного иона (катиона) всегда меньше, а радиус отрицательно заряженного нона (аниона) всегда больше радиуса соответствующего электронейтрального атома. Так, радиус атома калия составляет , а радиус иона радиусы атома хлора и иона соответственно равны 0,099 и . При этом радиус иона тем сильней отличается от радиуса атома, чем больше заряд иона. Например, радиусы атома хрома и ионов и составляют соответственно 0,127, 0,083 и .
В пределах одной подгруппы радиусы ионов одинакового заряда возрастают с увеличением заряда ядра. Это иллюстрируется следующими примерами (радиусы ионов даны в нм):

Такая закономерность объясняется увеличением числа электронных слоев и растущим удалением внешних электронов от ядра.
Атом, как обособленная единица, построен из ядра, заряженного положительным и из электронов, несущих отрицательных заряд. Вот из чего состоит атом.
В его центре располагается ядро, которое образуют ещё более мелкие частицы - протоны и нейтроны. Относительно радиуса всего атома радиус ядра примерно в сто тысяч раз меньше. Плотность ядра чрезвычайно высока.
Стабильная ядра с положительным зарядом - это протон. Нейтрон - это элементарная частица, не обладающая электрическим зарядом, с массой, приблизительно равной массе протона. Масса ядра складывается, соответственно, из общей и нейтронов, совокупность которых в составе ядра сокращённо называют нуклоном. Эти нуклоны в ядре связаны уникальными Число протонов в атоме равно определённому количеству электронов в атомной оболочке и, как следствие, составляет основу для химических свойств атома.
Электрон как мельчайшая частица вещества несёт в себе элементарный отрицательный электрический постоянно вращаются вокруг ядра по определённым орбитам подобно вращению планет вокруг Солнца. Таким образом, на вопрос о том, из чего состоит атом, можно дать следующий ответ: из элементарных частиц с положительными, отрицательными и нейтральными зарядами.
Существует следующая закономерность: размер атома зависит от размера его электронной оболочки, или высоты орбиты. В рамках ответа на вопрос о том, из чего состоит атом, можно уточнить, что электроны способны как добавляться, так и удаляться из атома. Это обстоятельство превращает атом в положительный ион или, соответственно, в отрицательный. А сам процесс трансформации элементарной химической частицы называют ионизацией.
В сконцентрирован большой запас энергии, которая способна высвобождаться во время ядерных реакций. Такие реакции, как правило, возникают при столкновении атомных ядер с другими элементарными частицами или с ядрами иных химических элементов. В результате способны образовываться новые ядра. Например, реакция способна осуществить переход нейтрона в протон, при этом из ядра атома удаляется бета-частица, иначе - электрон.
Качественный переход в центре атома протона в нейтрон способен осуществляться двумя вариантами. В первом случае из ядра выходит частица с массой, которая равна массе электрона, однако с положительным зарядом, называющаяся позитроном (так называемый позитронный распад). Второй вариант предполагает захват ядром атома одного из ближайшей к нему электронов с К-орбиты (К-захват). Так химические элементы превращаются из одного в другой благодаря тому, из чего состоит атом.
Бывают такие состояния образовавшегося ядра, когда оно обладает избытком энергии, иначе говоря, оно находится в возбуждённом состоянии. В случае перехода в естественное состояние ядро выделяет чрезмерную энергию в виде порции электромагнитного излучения с очень малой длиной волны - так образуется гамма-излучение. Та энергия, что выделяется при осуществляемых ядерных реакциях, находит практическое применение в ряде отраслей науки и промышленности.
Современный человек постоянно слышит словосочетания, которые содержат производные от слова «атом». Это энергия, электростанция, бомба. Кто-то принимает это как должное, а некоторые задаются вопросом: «Что такое атом?».
Что означает это слово?
Оно имеет древнегреческие корни. Происходит от «атомос», которое в дословном переводе значит «неразрезаемый».
Кто-то, уже немного знакомый с физикой атома, возмутится: "Как "неразрезаемый"? Он же состоит из каких-то частиц!" Все дело в том, что название появилось, когда ученые еще не знали, что атомы - не мельчайшие частицы.
После опытного доказательства этого факта было решено не менять привычного названия. И в 1860 году "атомом" стали называть мельчайшую частицу, которая имеет все свойства химического элемента, к которому относится.
Что больше атома и меньше его?
Молекула всегда больше. Она образована из нескольких атомов и является самой маленькой частицой вещества.
А вот меньше — элементарные частицы. Например, электроны и протоны, нейтроны и кварки. Их очень много.

Уже много чего про него сказано. Но до сих пор еще не очень понятно, что такое атом.
Что он из себя представляет?
Вопрос о том, как представить модель атома, уже давно занимает ученых. Сегодня принята та из них, которую предложил Э. Резерфорд и доработал Н. Бор. По ней атом разделяется на две части: ядро и электронное облако.

Большая часть массы атома сосредоточена в его центре. Ядро состоит из нейтронов и протонов. А электроны в атоме расположены на достаточно большом удалении от центра. Получается нечто похожее на Солнечную систему. В центре, как Солнце, ядро, и вокруг него вращаются электроны по своим орбиталям, как планеты. Именно поэтому модель часто называют планетарной.
Интересно, что ядро и электроны занимают очень малое пространство по сравнению с общими размерами атома. Получается, что в центре маленькое ядро. Потом пустота. Очень большая пустота. И потом узкая полоска маленьких электронов.
К такой модели атомов ученые пришли не сразу. До этого было выдвинуто множество предположений, которые были опровергнуты опытами.
Одной из таких идей было представление атома в виде сплошного тела, которое имеет положительный заряд. А электроны в атоме предлагалось разместить по всему этому телу. Такую идею выдвигал Дж. Томсон. Его модель атома еще называлась «Пудинг с изюмом». Уж очень модель напоминала это блюдо.
Но она была несостоятельна, потому что не могла объяснить некоторых свойств атома. Поэтому ее отвергли.
Японский ученый Х. Нагаока на вопрос, что такое атом, предлагал такую модель. По его мнению, эта частица имеет отдаленное сходство с планетой Сатурн. В центре ядро, а электроны вращаются вокруг него по орбитам, связанным в кольцо. Несмотря на то, что модель не была принята, некоторые ее положения были использованы в планетарной схеме.
О числах, связанных с атомом
Сначала о физических величинах. Общий заряд атома всегда равен нулю. Это связано с тем, что число электронов и протонов в нем одинаково. А их заряд одинаков по величине и имеет противоположные знаки.
Часто возникают ситуации, когда атом теряет электроны или, наоборот, притягивает к себе лишние. В таких ситуациях говорят о том, что он стал ионом. И его заряд зависит от того, что случилось с электронами. Если их количество стало меньше, заряд иона положительный. Когда электронов больше положенного, ион становится отрицательным.

Теперь о химии. Эта наука, как никакая другая, больше всего дает понимание, что такое атом. Ведь даже основная таблица, которая в ней изучается, основана на том, что атомы расположены в ней в определенном порядке. Речь идет о таблице Менделеева.
В ней каждому элементу приписывается определенный номер, который связан с числом протонов в ядре. Обычно он обозначается буквой z.
Следующее значение — это массовое число. Оно равно сумме протонов и нейтронов, находящихся в ядре атома. Принято его обозначение буквой A.
Два указанных числа связаны друг с другом таким равенством:
A = z + N .
Здесь N — это количество нейтронов в атомном ядре.
Еще одной важной величиной является масса атома. Для ее измерения введена особая величина. Она сокращается: а.е.м . И читается как атомная единица массы. Исходя их этой единицы, три частицы, из которых состоят все атомы Вселенной, имеют массы:
Эти значения часто нужны при решении химических задач.
Атом - частица вещества микроскопических размеров и массы, наименьшая часть химического элемента, являющаяся носителем его свойств.
Понадобилось чуть меньше 100 лет после принятия атомистической теории строения вещества, чтобы на границе следующих веков - XIX и XX - ученые сначала предположили, а затем доказали сложное строение атома. Оказалось, что атомы состоят из более мелких частиц. Английский физик Дж. Томсон впервые предложил модель атома, состоящего из заряженных частиц (1898 г.). Он практически открыл существование отрицательно заряженной частицы, присутствующей во всех веществах и названной затем электроном (от греч. electron - янтарь, как вещество, легко электризующееся при трении). В планетарной модели атома английского физика Э. Резерфорда (1911 г.) была впервые зафиксирована идея о существовании компактного положительно заряженного ядра, т.е. о концентрации массы и заряда в ничтожно малой части пространства внутри атома. Было установлено, что объем ядра примерно в 100 000 раз меньше объема всего атома.
В 1913 г. на основании экспериментальных результатов изучения Длин волн рентгеновского излучения различных металлов английский Ученый Г. Мозли высказал предположение о том, что основной характеристикой атома является заряд ядра, который увеличивается на единицу при переходе от одного элемента Периодической системы к следующему. К тому времени элементы располагались в Периодической системе в порядке увеличения атомных масс (в старой терминологии - атомных весов), в некоторых случаях элементу с меньшей атомной массой предшествовал элемент с большой атомной массой, в этих случаях порядок определялся сходством химических свойств. Г. Мозли предложил термин «атомный номер» (символ Z), который, как известно, равен числу протонов (от греч. proton - первый) в ядре, подведя, таким образом, теоретическую базу под систематизацию элементов в Периодической системе.
Экспериментально было установлено, что заряд протона равен заряду электрона по абсолютной величине. Поскольку атомы электронейтральны, стало ясно, что число протонов в атоме равно числу электронов. Масса электрона составляет приблизительно 1/1840 массы протона. Масса атома водорода совпадает с массой протона, однако массы многих легких атомов примерно в 2 раза больше суммарной массы содержащихся в них протонов. В связи с этим было сделано предположение о существовании электронейтральной частицы с массой, примерно равной массе протона. Она была открыта в 1932 г. английским физиком Д.Чедвиком и названа нейтроном (от греч. neut-гит - ни то, ни другое). Параметры фундаментальных частиц представлены в табл. 1.
Таблица 1. Абсолютные и относительные значения масс и зарядов частиц, из которых состоит атом
Частицы, из которых состоит ядро, - протоны и нейтроны - называются нуклонами (от лат. nucleus
- ядро). Массу атомов составляют в основном протоны и нейтроны, поэтому сумма числа протонов и нейтронов называется массовым числом.
Атомы, имеющие одинаковые массовые числа, но содержащие в ядре разное число протонов (изобары), являются атомами разных элементов. Например, атом с массовым числом 58, имеющий в ядре 27 протонов и 31 нейтрон, принадлежит кобальту, а атом с тем же массовым числом 58, имеющий в ядре 28 протонов и 30 нейтронов, принадлежит никелю.
Состояние электрона в атоме
Решение волнового уравнения Шредингера приводит к определению состояния электрона с помощью четырех квантовых чисел, два из которых были предложены еще до представлений о корпускулярно-волновом дуализме электрона.Первое (главное) квантовое число (n) характеризует удаленность электрона от ядра, т. е. размер орбитали. Чем больше значение главного квантового числа, тем электрон в среднем находится все дальше от ядра и тем большим запасом энергии он обладает. Разница в энергии между орбиталями, отличающимися значениями главного квантового числа, убывает по мере возрастания n. Главное квантовое число характеризует энергетический уровень орбитали, оно может принимать значения целых положительных чисел от 1 до +∞. При n → ∞ электрон полностью преодолевает притяжение со стороны ядра и отрывается от атома, который превращается в положительно заряженный ион. Максимально возможное значение n для электронов невозбужденного атома данного элемента соответствует номеру периода, в котором находится этот элемент, например для водорода n = 1, для серы n = 3, для свинца n = 6.
Чем больше значение n, тем большее число электронов может находиться на данном энергетическом уровне. Емкость энергетического уровня вычисляют по формуле 2n 2 . Таким образом, на первом энергетическом уровне могут находиться максимально 2·1 2 = 2 электрона, на втором - 2·2 2 = 8 электронов, на третьем - 2·3 2 = 18 электронов, на четвертом - 2·4 2 = 32 электрона.
При значениях n > 1 наблюдается расщепление энергетического уровня на подуровни. Это означает, что электроны, находящиеся на одном энергетическом уровне, несколько отличаются по запасу энергии и, как следствие этого, различаются формами атомных орбиталей.
Второе (орбитальное, побочное) квантовое число может принимать значения целых чисел в диапазоне 0 < l < n - 1. Число орбиталей, находящихся на данном энергетическом подуровне, рассчитывают по формуле 2l + 1. Например, при n = 2 возможны два значения l : 0 и 1. На энергетическом подуровне при l = 0 находится только одна орбиталь: 2·0 + 1 = 1; на подуровне при l = 1 их будет три: 2·1 + 1 = 3. Число подуровней на данном энергетическом уровне равно главному квантовому числу этого уровня.
Для второго квантового числа наиболее распространенными являются не цифровые, а буквенные обозначения: l
= 0 соответствует s-
, l
= 1 - p-
,l
= 2 - d-
,l
= 3 - f
-подуровню. На d
-подуровне находятся пять орбиталей, а на f
-подуровне - семь. Электроны, находящиеся на соответствующих подуровнях, называют s-, p-, d-, f-
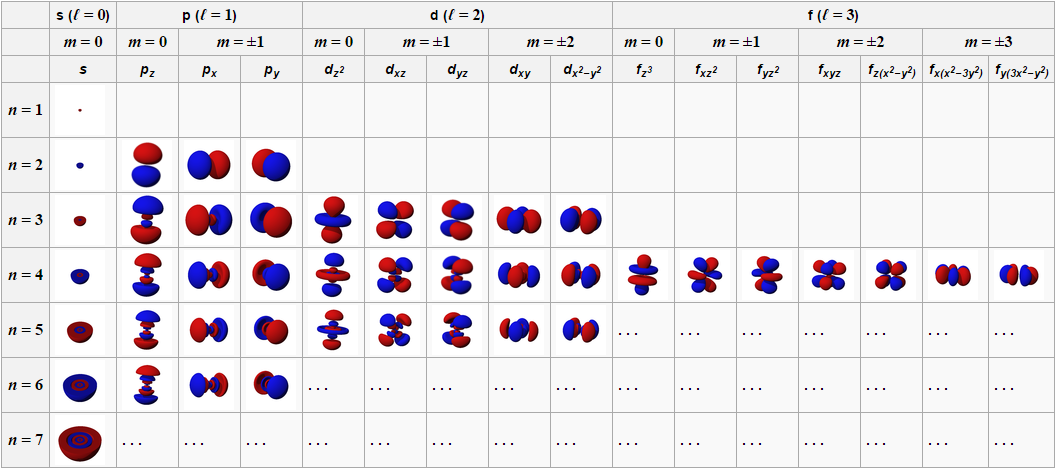
электронами. Согласно квантово-механическим представлениям s-орбиталь имеет сферическую форму, p-орбиталь - гантелеобразную (объемной восьмерки), d-орбиталь - четырехлопастную (клеверного листа). Формы орбиталей представлены на рисунке ниже:
Третье (магнитное) квантовое число m
характеризует взаимную пространственную ориентацию орбиталей в магнитном поле, возникающем в результате движения электронов по замкнутым орбиталям. Магнитное квантовое число принимает значения целых чисел, включая 0, в диапазоне -l
< m < +l
и показывает максимально возможное число орбиталей на каждом энергетическом подуровне. При l
= 0 магнитное квантовое число может иметь только одно значение - m = 0, следовательно, существует только одна s-орбиталь. Сферическая s-орбиталь симметрична относительно ядра и не имеет определенного направления в трехмерной системе координат. Для l
= 1 существуют три значения m (-1, 0, +1), т. е. три p-орбитали. Они различаются тем, что одна из них в трехмерной системе координат ориентирована вдоль оси x, другая — вдоль оси y и третья — вдоль оси z. Их часто называют соответственно p x , p y и p z -орбитали.
Орбитальному квантовому числу l
= 2 соответствуют пять d-орбиталей. Имея четыре лопасти, они ориентируются более сложным образом, различают d xz , d yz , d xy , d x² -y² , d z² .
Три квантовых числа характеризуют атомные орбитали. четвертое квантовое число - только электрон.
Четвертое (спиновое) квантовое число s принимает два значения: s = +½ и s = -½ Следует отметить, что спиновое квантовое число никак не связано с каким-либо его перемещением в пространстве, в том числе и с «вращением вокруг собственной оси» (скорость такого вращения должна превышать скорость света в вакууме), хотя это и отражено в названии (от англ. spin - волчок, веретено, вращение). Электрон имеет собственное магнитное поле, которое может ориентироваться параллельно или антипараллельно относительно магнитного поля, создаваемого взаимодействием электрона с ядром. Два значения спинового квантового числа соответствуют двум возможным способам квантования собственного магнитного момента относительно приложенного магнитного поля. Спин электрона не может быть изменен иди уничтожен. Электроны с противоположными значениями квантовых чисел отталкиваются друг от друга, стремясь занять другую атомную орбиталь. Одна атомная орбиталь, таким образом, может быть занята максимально двумя электронами, но при условии, что они имеют разные значения спинового числа. При изображении электронных конфигураций электроны, имеющие противоположный спин, обозначаются противоположно направленными стрелками: ↓.
Список использованной литературы
- Попков В. А. , Пузаков С. А. Общая химия: учебник. - М.: ГЭОТАР-Медия, 2010. - 976 с.: ISBN 978-5-9704-1570-2. [с. 15-16]



